
 .
.
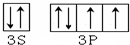
分析 (1)硫是16号元素,有6个价电子,根据核外电子排布规律书写电子排布图;
(2)原子总数相等、价电子总数相等的微粒互为等电子体;
(3)SO3的三聚体中S原子形成4个δ键,以此判断空间构型和杂化类型;SO3的三聚体中每个S形成,存在S=O键和S-O键,S=O键长较短;
(4)Na2O晶胞中阴离子位于晶胞的定点和面心,阳离子位于晶胞的体心,根据晶胞的结构判断配位数,Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,据此计算质量和体积,进而计算密度.
解答 解:(1)硫是16号元素,有6个价电子,价电子排布图为 ,故答案为:
,故答案为: ;
;
(2)原子总数相等、价电子总数相等的微粒互为等电子体,与SCN-互为等电子体的分子有N2O和CO2,故答案为:N2O和CO2;
(3)SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成,存在S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12,
故答案为:sp3;a;12;
(4)晶胞中O位于顶点,Na位于体心,每个晶胞中有1个Na与O的距离最近,每个定点为8个晶胞共有,则晶胞中O原子的配位数为8,Na的个数为8,O的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞的质量为$\frac{4×62g/mol}{6.02×10{\;}^{23}/mol}$,晶胞的体积为(0.566×10-7)3cm3,则晶体F的密度为$\frac{4×62g/mol}{(0.566×10{\;}^{-7}cm){\;}^{3}×6.02×10{\;}^{23}/mol}$=2.27g•cm-3,
故答案为:8;2.27.
点评 本题考查物质结构和性质,侧重考查学生空间想象能力、知识运用能力,涉及晶胞计算、原子结构等知识点,综合性较强,采用均摊法、价层电子对互斥理论等理论分析解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
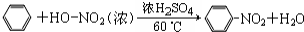 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 实验内容 | 实验目的 |
| A | 用平行光照射 | 区别淀粉溶液和氯化钠溶液 |
| B | 加入CaCO3粉末,充分反应后过滤 | 除去CaCl2溶液中的FeCl3 |
| C | 通过灼烧的Cu粉末,收集气体 | 除去N2中的少量O2 |
| D | 滴入稀盐酸,同时用pH计测定至溶液呈中性 | 除去KNO3溶液中的KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加蒸馏水 | B. | 加浓盐酸 | C. | 加AgNO3溶液 | D. | 加氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
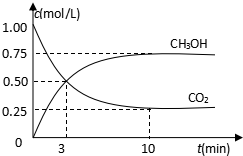 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
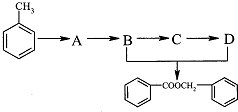
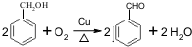
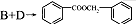 的化学方程式为
的化学方程式为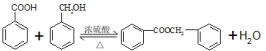
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com