
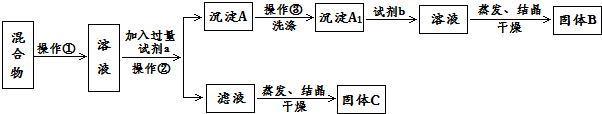
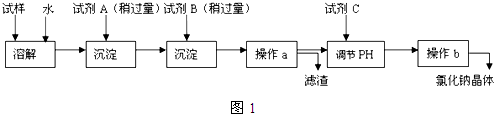
分析 分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸可得KCl,据此进行解答.
解答 解:(1)将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,
故答案为:溶解;过滤;
(2)固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,
故答案为:K2CO3;HCl;BaCl2;
(3)加入试剂a,K2CO3与BaCl2反应生成BaCO3沉淀,发生的离子方程式为CO32-+Ba2+=BaCO3↓,
加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O.
(4)蒸发结晶前应加入适量稀盐酸,将过量的碳酸钾转化成氯化钾,否则晶体不纯,所以该方案不否达到实验目的,
故答案为:否;应在操作②的滤液中加入过量盐酸后再蒸发结晶;
(5)固体溶解后加入过量K2CO3使BaCl2转化为碳酸钡沉淀,过滤后沉淀加入试剂b盐酸可将碳酸钡转化成BaCl2溶液,然后经蒸发、结晶、干燥后可得固体BaCl2,若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是固体B或沉淀A1的质量,依据B为BaCl2计算得到质量分数,A1为碳酸钡,结合钡元素守恒计算氯化钡质量得到,
故答案为:固体B或沉淀A1的质量.
点评 本题考查物质的分离、提纯操作,题目难度不大,注意把握物质的性质,根据性质选择反应试剂,把握化学基本实验操作知识.


科目:高中化学 来源: 题型:选择题
| A. | 钠和铁 | B. | 镁和铜 | C. | 铝和镁 | D. | 锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
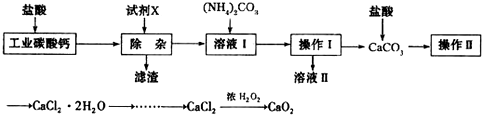
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物的年代鉴定,14C与12C互为同素异形体 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 服用铬含量超标的药用胶囊会对人体健康造成危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
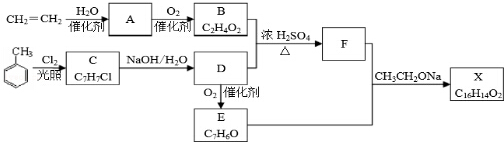
 .
. .
. B.
B. 
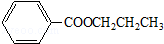
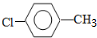 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.如果A、B均由三种元素组成,B为两性不溶物,则由A与过量的C反应转化为B的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
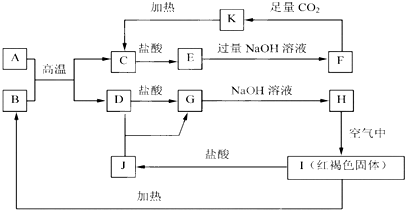
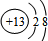 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com