
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是____________,烧瓶中发生的反应的化学方程式是______________________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是__________________。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________________________,该反应的离子方程式是____________________________,该反应属于四种基本反应类型中的__________反应。
A.Na2S溶液 B.Na2SO3溶液
C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A.全部 B.②③④⑥⑦
C.①②④⑤⑥ D.②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:________________________。
【答案】浓盐酸 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O ![]() 饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2===2Cl-+S↓ 置换 B Cl2+2OH-===Cl-+ClO-+H2O
饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2===2Cl-+S↓ 置换 B Cl2+2OH-===Cl-+ClO-+H2O
【解析】
(1)为验证氯元素的非金属性比硫元素的非金属性强,根据实验装置的特点,可以确定需要用氯气置换出硫,则必须用装置A制备氯气,从实验室制取氯气的原理分析解答此题;
(2)由于用浓盐酸制取氯气需要加热,实验过程中会挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,所用装置为洗气装置;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液;
(4)比较元素的非金属性强弱可根据:元素对应最高价氧化物的水化物的酸性;氢化物的还原性、稳定性强弱;与氢气反应的难易程度以及单质的氧化性的强弱等角度;
(5)装置C中盛放烧碱溶液,用易吸收多余的氯气,防止污染空气。
(1)实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中的分液漏斗中盛装的试剂是浓盐酸,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
本题答案为:浓盐酸、MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)由于用浓盐酸制取氯气需要加热,实验过程中会挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为: ![]() ;
;
本题答案为:![]() ,饱和食盐水,除去Cl2中的HCl气体。
,饱和食盐水,除去Cl2中的HCl气体。
(3)要在B中发生氯气置换出硫的反应,氯元素的非金属性比硫元素的非金属性强,在给定试剂中只能选取Na2S溶液,发生的是置换反应,生成淡黄色的S沉淀,化学方程式为:Na2S+Cl2=2NaCl+S↓;
本题答案为:A,有淡黄色沉淀生成,Na2S+Cl2=2NaCl+S↓,置换。
(4)①硫酸比次氯酸稳定,不能用来比较非金属性强弱;
②元素对应最高价氧化物的水化物的酸性越强,对应的元素的非金属性越强,可说明非金属性Cl>S;
③元素的非金属性越强,对应单质的氧化性越强,则阴离子的还原性越弱,S2-比Cl-易被氧化,可说明非金属性Cl>S,;
④元素的非金属性越强,氢化物越稳定,HCl比H2S稳定,可说明非金属性Cl>S;
⑤铜与盐酸不反应,但能与浓硫酸反应,不能判断非金属性强弱;
⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁,说明氯气的氧化性比硫强,则可说明非金属性Cl>S;
⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子,说明氯元素的原子比硫元素的原子更容易得到电子,则可说明氯元素的非金属性比硫元素强。
综上所述,能说明氯的非金属性比硫强的是②③④⑥⑦;
本题答案为B。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,反应的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O;
本题答案为:Cl2+2OH-===Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )
图 1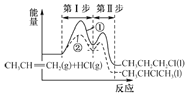 图 2
图 2 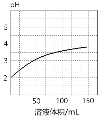 图 3
图 3 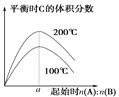 图 4
图 4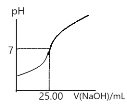
A.由图1可知反应②的第I步比第Ⅱ步反应速率快
B.若图2为1 mL pH=2某一元酸溶液加水稀释时pH随溶液总体积的变化曲线,则说明该酸是强酸
C.由图3知反应3A(g)+2B(g) 2C(g) 的 ΔH>0,且a=1.5
D.若图4表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量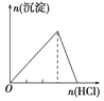
B.向 AlCl3 溶液中逐滴 滴加氨水至过量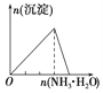
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量
D.向澄清石灰水中缓缓 通入 CO2 至过量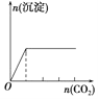
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
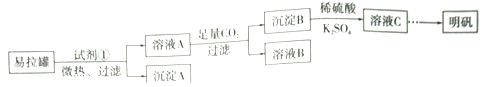
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。
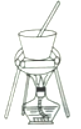
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是![]()
![]()
![]()
A.SO42-B.Br-C.H2SO3D.NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列有关问题
(1)KW的数学表达式是KW =__________,温度升高KW的变化情况是______(选填“变大”“变小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越________,对于反应2NO2(g) ![]() N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性_______,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Kα的变化情况是________(选填“变大”“变小”或“不变”)
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的__________。
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为_____________。(已知HNO2的电离常数Ka=7.1×104 mol/L,CH3COOH的电离常数为:Ka=1.7×105 mol/L),可使溶液A和溶液B的pH相等的方法是_____________。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
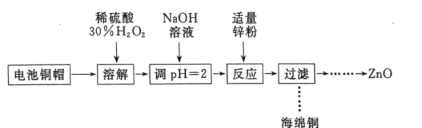
下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com