
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
【答案】D
【解析】
A. 根据反应①可知,△H1=413kJ/mol×4+2xkJ/mol(798×2+463×4)kJ/mol=akJ/mol,整理可得:x=![]() ,故A错误;
,故A错误;
B. ①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=akJ/mol、②CH4(g)+2O2(g)═CO2(g)+2H2O(g)
△H2=bkJ/mol,根据盖斯定律![]() (①②)可得:H2O(g)═H2O(l)△H=
(①②)可得:H2O(g)═H2O(l)△H=![]() (ba)kJ/mol,故B错误;
(ba)kJ/mol,故B错误;
C. 有4NA个CH键断裂时,反应消耗了1mol甲烷,若按照反应①进行,放热热量为akJ,若按照反应②进行,放热热量为bkJ,故C错误;
D. 电解精炼铜时,当负极输出0.2NA个电子时,转移电子的物质的量为0.2mol,阴极上铜离子得电子生成铜单质,生成铜的物质的量为![]() =0.1mol,质量为:64g/mol×0.1mol=6.4g,故D正确;
=0.1mol,质量为:64g/mol×0.1mol=6.4g,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()
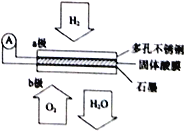
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与性质
(1)元素As与N同族。As的氢化物沸点比NH3的___(填“高”或“低”),其判断理由是______。
(2)铜原子在基态时的价电子排布式为______。
(3)Fe是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:_____。与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系____。某同学所画基态镁原子的核外电子排布图如图![]() ,该同学所画的电子排布图违背了______。
,该同学所画的电子排布图违背了______。
(4)K元素处于元素周期表的____区,其基态原子中,核外电子占据的电子云轮廓图为球形的能级有____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. CH3OH(l)的燃烧热为1 452 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+—SO42-+Mn2++H2O)回答以下问题:
(1)化学小组要紧选用了以下药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
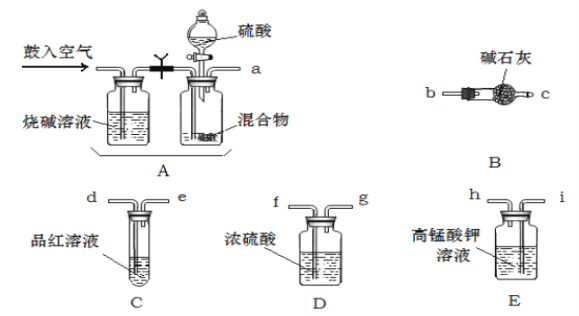
请按气流由左向右的方向,仪器连接顺序是〔填仪器的接口字母a、b...)a→_______f→g→_______。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是_______。
(3)E装置的作用是:_______。
(4)实验中,假设C试管中溶液褪色,那么测定结果可能会偏_______,为了确保实验中C试管中溶液不褪色,假设取样品的质量为mg,实验前E中所装amol·L-1的KMnO4溶液体积〔V〕应多于______mL;
(5)假设混合物样品质量为9.875g,充分作用后碱石灰增重4.4g,那么混合物中NH4HCO3的质量分数为_______。
(6)从定量测定的准确性的角度考虑,该套装置还应作进一步的改进,改进的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机A是衡量一个国家石油化学工业的发展水平,D的分子式为C2H5Cl,C是一种常见的高分化合物。请回答下列问题:
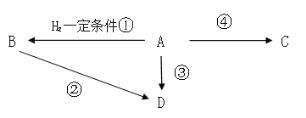
(1)写出A的结构式___;
(2)写出②的方程式___;途径②、③都可以得到D,更合理的是途径___,理由是___;
(3)写出区别A、B两种物质的一种试剂___;
(4)写出④的方程式___;
(5)体育比赛中,当运动员扭伤或肌肉挫伤时,队医随即对准运动员的受伤处喷射液体D(沸点12.27℃)进入局部冷冻麻醉处理,原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测定H2C2O4·xH2O 中x值: 已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式______________。
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
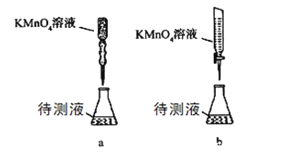
(3)滴定过程中眼睛应注视______________________。
(4)通过上述数据,求得x=____________。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______(偏大、偏小或没有影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com