
【题目】某化学兴趣小组在实验室利用质子酸甲醇燃料电池作电源,电解硫酸铜溶液. 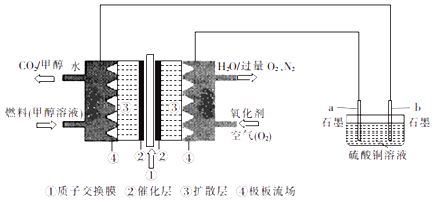
请回答下列问题:
(1)通入氧气的电极为(填“正极”或“负极”),通入甲醇一极的电极反应式为 .
(2)b电极上的现象为 .
(3)假设硫酸铜溶液的体积为600mL(电解前后溶液的体积变化忽略不计),若消耗336mL(标准状况)O2 , 则电解后硫酸铜溶液的pH为 .
(4)若a、b均换成铜电极,则电解一段时间后硫酸铜溶液的浓度(填“增大”“减小”或“不变”).
【答案】
(1)正极;CH3OH﹣6e﹣+H2O=CO2↑+6H+
(2)石墨电极表面有紫红色固体析出
(3)1
(4)不变
【解析】解:(1)燃料电池中,通入燃料甲醇的电极是负极,通入氧气的电极是正极,燃料电池的负极上是燃料甲醇发生失电子的氧化反应,电解质环境是酸性,则电极反应为CH3OH﹣6e﹣+H2O=CO2↑+6H+ , 所以答案是:正极;CH3OH﹣6e﹣+H2O=CO2↑+6H+;(2)电解池中,和电源负极相连的极b是阴极,和电源正极相连的a极是阳极,电解硫酸铜溶液,在阴极上是铜离子得电子生成铜,该电极上有紫红色固体析出,
所以答案是:石墨电极表面有紫红色固体析出;(3)在燃料电池的正极上,正极反应为O2↑+4H++4e﹣=2H2O,当消耗336mL即0.015mol氧气时,转移电子物质的量是0.06mol,电解硫酸铜溶液是放氧生酸型,根据电解方程式2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4~4e﹣可知转移电子0.06mol时,生成硫酸物质的量是0.03mol,氢离子物质的量为0.06mol,
2Cu+O2↑+2H2SO4~4e﹣可知转移电子0.06mol时,生成硫酸物质的量是0.03mol,氢离子物质的量为0.06mol,
则 ![]() =
= ![]() =0.1mol/L,pH=1,
=0.1mol/L,pH=1,
所以答案是:1;(4)若a、b均换成铜电极,则阳极铜失电子生成铜离子,阴极是铜离子得电子析出铜,溶液中的铜离子浓度不变,
所以答案是:不变.


科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是 ( )
A. 由共价键形成的物质一定是共价化合物
B. 只有金属元素和非金属元素化合时才能形成离子键
C. 分子中不一定存在化学键
D. 共价化合物可能含离子键,离子化合物可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,HA的电离平衡常数Ka=6.25×10﹣5 , H2CO3的电离平衡常数Ka1=4.17×10﹣7、Ka2=4.90×10 ﹣11 . 在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法不正确的是(不考虑饮料中其他成分)( ) A.相同物质的量浓度的Na
A.HA混合溶液呈碱性
B.提高CO2兖气压力,碳酸饮料中c (A﹣)减小
C.当碳酸饮料的pH为5.0时, ![]() =0.16
=0.16
D.碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3﹣)+2c( CO32﹣)+c(OH﹣)﹣c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业.从切割废料中回收银并制备铜化工产品的工艺如图:
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式: .
(2)固体混合物A的组成为、 .
(3)操作A的名称为 .
(4)若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2 , 至少需要1.0molL﹣1的Al2(SO4)3溶液 L.
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是、、过滤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。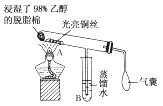
实验操作:预先使棉花团浸透乙醇并照图安装好;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为。
(2)A管中可观察到现象。
从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的。
(3)实验一段时间后,如果撤掉酒精灯,反应(填“能”或“不能”)继续进行。原受热的铜丝处的现象是 , 原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的物质都是离子化合物的是( )
A. H2SO4、Ba(OH)2、CaCl2、MgO B. NaBr、KNO3、Ca(OH)2、SiO2
C. NaOH、CaO、HCl、CH3COONa D. KOH、(NH4)2SO4、Na2O2、NaH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答: 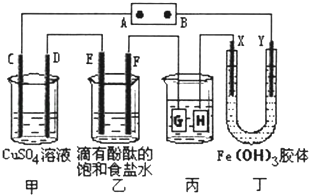
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 .
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀.他测得溶液的pH=5,则此时溶液中c(Fe3+)=mol/L.(己知Ksp=1×10﹣36).
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL.当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com