
下列溶液中Cl-浓度与50mL 1mol·L -1 MgCl2溶液中Cl-物质的量浓度相等的是
A.50mL 1mol·L -1的FeCl3溶液
B.75mL 2mol·L -1 NH4Cl溶液
C.100mL 2mol·L -1的CaCl2溶液
D.150mL 1mol·L -1的NaCl溶液
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:填空题
(14分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)
(1)硝酸在该反应中表现出的性质是_____,该反应的还原产物是_____。
(2)0.4molCu被硝酸完全溶解后,硝酸得到的电子数是_____,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是_____mol。
(3)0.3molCu被另一浓度的硝酸完全溶解后,如果此时产生的NO和NO2气体总体积在标准状况下为8.96 L,则被还原的硝酸的物质的量是_____ mol,参加反应的硝酸的物质的量是_____mol,产生的混合气体中NO和NO2体积比为_______。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
在做中和热实验测定中和热时,应使用的仪器正确的组合是:
①量筒 ②托盘天平 ③烧杯 ④容量瓶 ⑤冷凝管 ⑥温度计 ⑦酒精灯
A.①③⑥ B.②③⑤ C.①②③⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
某粒子用符号AZMn+表示,下列关于该粒子的叙述中,正确的是
A.所含质子数为(A-n) B.所含中子数为(A-Z)
C.所含电子数为(Z+n) D.中子数-电子数=A-2Z-n
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
B.向某溶液中加入氢氧化钠固体,加热若产生能使湿润的蓝色石蕊试纸变红的气体,则该溶液中含有NH4+
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:填空题
(14分)如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
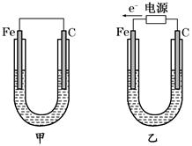
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_____________________________。
②甲装置中碳极的电极反应式是 ,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因: 。
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
反应C (s) + H2O (g) ? ?CO (g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变能加快其反应速率的是
?CO (g) + H2(g)在一可变容积的密闭容器中进行,下列条件的改变能加快其反应速率的是
A.保持体积不变,充入N2使体系压强增大
B.增加C的量
C.保持压强不变,充入N2 使容器体积变大
D.将容器的体积缩小一半
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:填空题
(本题6分)依据某氧化还原反应设计的原电池如图所示。
(1)该氧化还原反应的离子方程式为_________________________________。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出铜片和银片洗净干燥后称重,总质量为67.6g,请计算:通过导线的电子的物质的量。(要求有计算过程)

查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
最近我国质检总局通报,日本佳丽宝公司生产的化妆品使用后皮肤会出现白斑,其中的有害成分为杜鹃醇(结构如图),有关杜鹃醇的说法不正确的是

A.分子式为:C10H14O2
B.水溶液酸性一定比碳酸强
C.能与FeCl3溶液发生显色反应
D.最多可与含3molBr2的溴水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com