
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g),反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%.计算:
(1)达到平衡时,消耗N2的物质的量,n(N2)=
(2)原混合气体与平衡混合气体的压强之比(写出最简整数比),p(始):p(平)= .
考点:
化学平衡的计算.
专题:
化学平衡专题.
分析:
(1)根据n=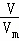 计算氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量;
计算氨气的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的氮气的物质的量;
(2)根据氨气的体积分数计算平衡时混合气体总的物质的量,利用差量法计算混合气体到达平衡时减少的物质的量,进而计算起始氮气与氢气的总的物质的量,再利用压强之比等于物质的量之比解答.
解答:
解:(1)平衡时,氨气的体积为716.8L(标准状况下),故氨气的物质的量为 =32mol,根据方程式可知,参加反应的氮气的物质的量n(N2)=32mol×
=32mol,根据方程式可知,参加反应的氮气的物质的量n(N2)=32mol×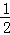 =16mol,故答案为:16mol;
=16mol,故答案为:16mol;
(2)平衡时氨气的物质的量为32mol,平衡时NH3的体积分数为25%,则平衡时混合气体总的物质的量为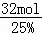 =128mol,则:N2(g)+3H2(g)⇌2NH3(g) 气体体积减少△V
=128mol,则:N2(g)+3H2(g)⇌2NH3(g) 气体体积减少△V
2 2
32mol 32mol
故起始时氮气、氢气总的物质的量为:128mol+32mol=160mol,
压强之比等于物质的量之比,故p(始):p(平)=160mol:128mol=5:4,
故答案为:5:4.
点评:
本题考查化学平衡的有关计算,难度不大,注意(2)中利用差量法进行的计算,可以简化计算过程,注意基础知识的理解掌握.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
.工业合成氨与制备硝酸一般可连续生产,流程如图所示:
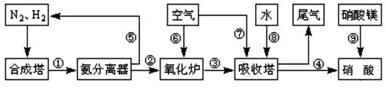
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
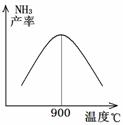
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
|
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ③⑤⑥⑦ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
用NaOH滴定pH相同、体积相同的H2SO4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
|
| A. | V1>V2>V3 | B. | V1<V2<V3 | C. | V1=V2>V3 | D. | V1=V2<V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成如图装置,下列各叙述中正确的是( )
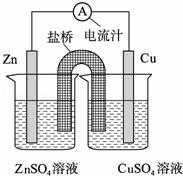
|
| A. | 构成原电池,锌片作正极 |
|
| B. | 锌片上有铜析出,铜片上没有 |
|
| C. | 铜片附近Cu2+离子浓度减小 |
|
| D. | 盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是 ( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡
②配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线
③中和滴定时,锥形瓶内有少量水
④酸式滴定管用蒸馏水洗后,未用标准液洗
⑤读取滴定管终点读数时,仰视刻度线.
|
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10﹣14 | KW | 1×10﹣12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW 1×10﹣14(填“>”、“<”或“=”),判断的理由是
(2)25℃下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1:V2= .
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸
性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO﹣)(填“>”、“=”或“<”).
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、“中”
或“碱”),溶液中c(Na+) c(CH3COO﹣)[填“>”、“=”或“<”]
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的
pH 7(填“大于”、“小于”或“等于”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是: (填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z.在原子结构示意图中,X原子的电子层数与它的核外电子总数相同,Z原子有两个电子层,外层电子数是内层的电子数的三倍,则
(1)X是H,Z是O.Y的原子结构示意图 ,
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是 .
(3)X、Z可以形成两种化合物A和B,A中原子个数比为1:2,则A的摩尔质量是 ,B中两原子个数比为1:1,实验室常用B制备少量的氧气,写出化学反应方程式
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4:2:3,该盐的名称 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com