
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
| A、任何一个化学反应都能达到一个化学平衡状态 |
| B、当可逆反应在一定条件下达到最大限度是,正反应速率和逆反应速率相等 |
| C、平衡状态是一种静止的状态 |
| D、化学反应的限度不可能通过改变外界条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入催化剂,反应速率加快,反应的也随之改变 |
| B、升高温度,反应速率加快,反应放出的热量不变 |
| C、改变压强,平衡不发生移动,反应放出的热量不变 |
| D、如果将该反应设计成原电池,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸检验牙膏中的摩擦级碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑ |
| B、漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C、酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
| D、Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1-2.25a% |
| B、2.25a% |
| C、1-1.75a% |
| D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol.L-1 |
| B、0.2mol.L-1 |
| C、0.4mol.L-1 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
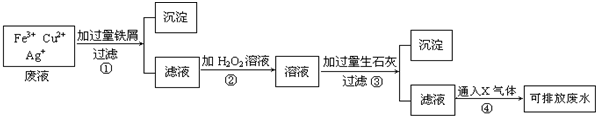
查看答案和解析>>
科目:高中化学 来源: 题型:
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.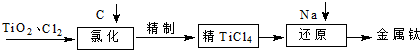
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com