
【题目】设NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,2.24L SO3中含有的SO3分子数为0.1NA
B.5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA
C.将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
D.1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( ) 
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4CO(g)+2NO2(g)N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )
A.v(CO)=1.2 mol/(Ls)
B.v(NO2)=0.3 mol/(Lmin)
C.v(N2)=0.6 mol/(Lmin)
D.v(CO2)=1.2 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中不正确的是( ) 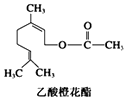
A.分子式为C12H20O2
B.1 mol该有机物水解时只能消耗1 mol NaOH
C.1mol该有机物可消耗3molH2
D.不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁二酮肟 ![]() 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.
(1)Ni2+基态核外电子排布式为 . 丁二酮肟分子中C原子轨道杂类型为 , 1mol丁二酮肟分子所含σ键的数目为 .
(2)Ni能与CO形成四羰基镍[Ni(CO)4],四羰基镍熔点﹣19.3℃,沸点42.1℃,易溶于有机溶剂.
①Ni(CO)4固态时属于晶体(填晶体类型).
②与CO互为等电子体的阴离子为(填化学式).
(3)Ni2+与Mg2+、O2﹣形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知某溶液中c(Na+)=0.4mol/L,c(Mg2+)=0.25 mol/L,c(SO42-)=0.4 mol/L ,如果溶液中还有Cl-,那么c(Cl-)应为
A. 0.1 mol/L B. 0.15 mol/L C. 0.2 mol/L D. 0.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中除杂所选用的试剂及操作方法均正确的组合是(括号内为杂质)
待提纯的物质 | 选用的试剂 | 操作方法 | |
A | I2(水) | 乙醇 | 萃取、分液 |
B | CO2 (CO) | O2 | 点燃 |
C | Zn (Cu) | 稀硫酸 | 过滤 |
D | 乙醇(水) | 生石灰 | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=﹣1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol
B.若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定
C.已知H+(aq)+OH﹣(aq)═H2O(1)△H=﹣57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量
D.已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)某温度下,纯水中的c(H+)=2.0×10﹣7mol/L,此时溶液的c(OH﹣)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”).
(2)某温度下的水溶液中,C (H+)=10x mol/L,C (OH﹣)=10y mol/L,x和y的关系如图所示.计算:该温度下水的离子积为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com