
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下两组实验:①T1K时,将2mL0.02mol·L-1的酸性KMnO4溶液与2mL0.2mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是4s;②T2K 时,将2mL0.03 mol·L-1的酸性KMnO4溶液与2mL0.2 mol·L-1草酸溶液混合,观察到溶液完全褪色所需要的时间是5s。下列说法正确的是
A.实验①反应速率较快B.实验②反应速率较快
C.无法比较二者反应速率的快慢D.T2—定高于T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
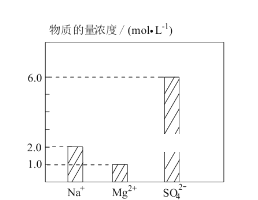
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应的平衡常数K1为________。
(2)100 ℃时达平衡后,将反应容器的容积增大一倍,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后N2O4的浓度范围是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.用水稀释0.1mol·L-1的氨水,则溶液中![]() 减小
减小
B.pH=3的盐酸和醋酸分别升高相同的温度,CH3COOH的pH变大
C.在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出H+,反应速率比盐酸大
D.两种氨水的pH分别为a和a+1,物质的量浓度分别为c1和c2,则c2<10c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过一硫酸氢钾复合盐(KHSO4·2KHSO5·K2SO4)常用作漂白剂和消毒剂,其制备流程如下:
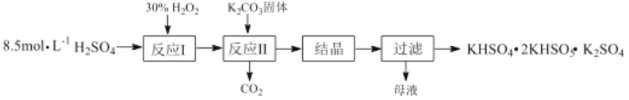
(1)反应Ⅰ的化学方程式为:H2O2+H2SO4![]() H2SO5+ H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为_____________。
H2SO5+ H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为_____________。
(2)生产原料的理论比值[n(H2O2):n(H2SO4)]为0.4:1,但实际生产最佳投料比为 0.6:1,其原因是_________________。
(3)过一硫酸氢钾复合盐可以处理废水中的H2S。己知:25℃,H2S的电离常数Ka1=1.1×10-7, Ka2=1.3×10-13由于电离常数值极小,H2S水溶液中H2S的平衡浓度近似等于H2S的初始浓度。0.090 mol·L-1H2S溶液的pH=4,该溶液中c(S2-)=________________。
(4)准确称取3.350g复合盐样品配制成250mL溶液,取25.00 mL置于锥形瓶中,加入适量的稀硫酸和足量的KI溶液,摇匀后置于暗处,充分反应后,加入少量淀粉溶液,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消粍标准溶液20.00 mL。计算复合盐中有效成分KHSO5的质量分数。(写出计算过程)(已知:HSO5- ![]() I2
I2 ![]() S4O62-)________________________。
S4O62-)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出):

(1)物质I的化学式为________;
(2)在反应①中,当生成标准状况下丁气体4.48L时,反应转移的电子数约为___________;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为________________;
(4)反应②的化学方程式为_____________;
(5)若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为________;
(6)写出实验室检验F中阴离子的方法_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com