
分析 A、B、C是短周期非金属元素,核电荷数依次增大.C是地壳中含量最多的元素,则C为O元素;A原子外围电子排布为ns2np2,处于ⅣA族,原子序数小于O,故A为碳元素;B的原子序数介于C、O之间,则B为氮元素;D元素的核电荷数为29,则D为Cu,据此解答.
解答 解:A、B、C是短周期非金属元素,核电荷数依次增大.C是地壳中含量最多的元素,则C为O元素;A原子外围电子排布为ns2np2,处于ⅣA族,原子序数小于O,故A为碳元素;B的原子序数介于C、O之间,则B为氮元素;D元素的核电荷数为29,则D为Cu.
(1)同周期随原子序数增大,第一电离能呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,其第一电离能高于O氧元素,故第一电离能C<O<N,
故答案为:C<O<N;
(2)(CN)2每个原子最外层电子数均满足八电子,其结构式为:N≡C-C≡N,1mol该分子中含有π键的数目为4NA,分子中碳原子成2个σ键、没有孤电子对,故C原子采取sp杂化,(CN)2中键与键之间的夹角为180°,说明该分子为对称直线型,正负电荷中心重合,属于非极性分子.
故答案为:N≡C-C≡N;4NA;sp;非极性;
(3)根据核外电子排布规律可知,Cu元素原子核外电子排布为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1.
点评 本题是对物质结构的考查,涉及电离能、杂化轨道、化学键、分子结构与性质、核外电子排布等,比较基础,注意理解同周期第一电离能发生突变情况.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的一种单质是自然界中最硬的物质;Y的单质在空气中含量最高.Z 的氧化物是常见的两性氧化物;R 基态原子最外层成对电子的数目和未成对电子 的数目相等. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 表示碳原子,
表示碳原子, 表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )
表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )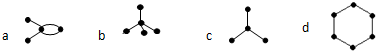
| A. | a和c互为同分异构体 | B. | b能使酸性高锰酸钾溶液褪色 | ||
| C. | b和c互为同系物 | D. | 常温下d为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
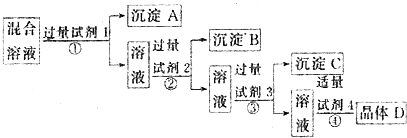
| A. | 氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液 | |
| B. | 硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液 | |
| C. | 氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液 | |
| D. | 硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
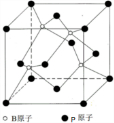
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子 | |
| B. | SO2和CO2都属于酸性氧化物,Na2O和A12O3都属于碱性氧化物 | |
| C. | 在氯化铵水溶液中,既存在水解平衡,又存在电离平衡 | |
| D. | O2在放电的条件下生成O3属于化学变化,电解质溶液导电属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
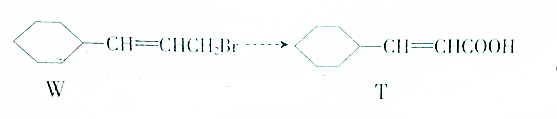
| A. | ①③②④ | B. | ③①④② | C. | ②①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com