
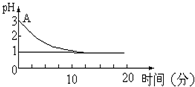
 关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:
关于“电解氯化铜溶液时的pH值变化”问题,化学界有以下两种不同的观点:分析 (1)CuCl2是强酸弱碱盐,Cu 2+水解导致溶液呈酸性;
(2)电解过程中,Cu 2+放电能力大于H+、Cl-放电能力大于OH-,所以实质上是电解CuCl2,随着c(Cu2+)的降低,Cu2+的水解平衡向左移;
(3)根据图知,随着反应进行,溶液的pH减小,溶液酸性增强;电解产生的氯气有一部分溶解在溶液中,使溶液中的H+离子浓度增大,溶液的pH减小.
解答 解:(1)CuCl2是强酸弱碱盐,Cu 2+水解导致溶液呈酸性,水解方程式为Cu2++2H2O?Cu(OH)2+2H+,
故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(2)电解过程中,Cu 2+放电能力大于H+、Cl-放电能力大于OH-,所以实质上是电解CuCl2,随着c(Cu2+)的降低,Cu2+的水解平衡向左移,导致溶液中的c(H+)下降,溶液的pH值会升高(但不会超过7),
故答案为:电解时,Cu2+可在阴极析出,随着c(Cu2+)的降低,Cu2+的水解平衡向左移,导致溶液中的c(H+)下降,溶液的pH值会升高(但不会超过7);
(3)根据图知,随着反应进行,溶液的pH减小,溶液酸性增强;该实验是利用pH电解产生的氯气有一部分溶解在溶液中,使溶液中的H+离子浓度增大,所以随着电解过程的进行,溶液的pH值降低,
故答案为:溶液的pH值下降;pH计;电解产生的氯气有一部分溶解在溶液中,使溶液中的H+离子浓度增大,而且这种影响是实验过程中溶液pH值变化的主要因素,所以随着电解过程的进行,溶液的pH值降低.
点评 本题考查电解原理,为高频考点,明确理论与实际的区别是解本题关键,知道电解过程中离子放电顺序,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数不同,属于两种元素 | |
| B. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、H2互为同位素 | |
| C. | 14462Sm其原子核内中子数和质子数都是62 | |
| D. | O2和O3互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①②⑤ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol NH5中含有5NA个N-H键(NA为阿伏加德罗常数) | |
| B. | NH5中既有共价键,又有离子键 | |
| C. | NH5的电子式为: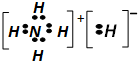 | |
| D. | 与水反应时,水作氧化剂,生成1mol氢气,转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9kJ/mol,可知金刚石比石墨稳定 | |
| C. | 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol | |
| D. | 在稀溶液中,H+ (aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com