
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的 |
| 化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | A、反应是吸热反应,升温,平衡正向进行, B、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,相对分子质量增大; C、通入稀有气体总压增大,分压不变,平衡不动; D、速率之比等于化学方程式的系数之比,平衡状态正逆反应速率相同. |
| 解答: | 解:A、反应是吸热反应,升温,平衡正向进行 B、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,混合气体的相对分子质量增大,故B正确; C、通入稀有气体总压增大,分压不变,平衡不动,故C错误; D、速率之比等于化学方程式的系数之比,v(X)正:v(Y)正=m:n,平衡时,X的正反应速率是Y的逆反应速率的 故选B. |
| 点评: | 本题考查了化学平衡影响因素分析判断,化学平衡移动原理和反应特征是解题关键,注意惰气对平衡影响分析方法,题目难度中等. |


科目:高中化学 来源: 题型:
现用98%的浓硫酸(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500ml.
(1)选用的主要仪器有:
①②烧杯③玻璃棒④⑤胶头滴管
(2)请将下列操作按正确的顺序把序号填在横线上
A.用量筒量取浓硫酸 B.反复颠倒摇匀
C.用胶头滴管加水至刻度 D.洗涤所用仪器
E.稀释浓硫酸 F.将溶液转入容量瓶
其操作的正确顺序为A.
(3)简要回答下列问题:
①所需浓H2SO4的体积为mL.
②如果实验室有15mL,20mL,25mL的量筒,选用15mL的量筒最好.量取时发现量筒不干净,用水洗涤后直接量取将使实验最终结果(填“偏高”、“偏低”或“无影响”).
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是.若搅拌过程中有液体飞溅,会使最终结果填“偏高”、“偏低”或“无影响”).
④在转入容量瓶前烧杯中液体应,否则会使浓度偏高(填“偏高”、“偏低”或“无影响”,下同);洗涤烧杯2﹣3次,洗液也要转入容量瓶,否则会使浓度偏低;定容时俯视会使结果,仰视会使结果.
查看答案和解析>>
科目:高中化学 来源: 题型:
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 ;(填加深、变浅、不变)
④加入催化剂D,平衡 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 ;(填增大、减小、不变)
②增加B的量,A的转化率 .(填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下面有关丙烷、丙烯、丙炔说法中正确的是
A.如图,丙烷、丙烯、丙炔的结构分别表示为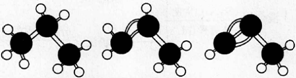
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3 : 2 : 1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相同条件下密度逐渐增大
D.丙炔的碳原予空间结构呈线性排列
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)⇌2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图.下列说法正确的是( )
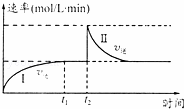
|
| A. | 0~t2时,v正>v逆 |
|
| B. | t2时刻改变的条件可能是加催化剂 |
|
| C. | Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
|
| D. | Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
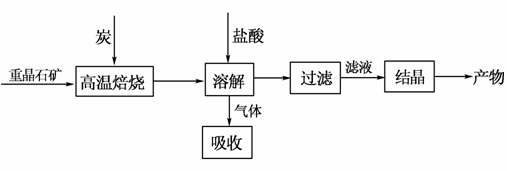
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)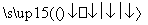 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)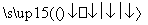 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________。
(2)反应C(s)+CO2(g)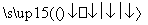 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(3)实际生产中必须加入过量的炭,同时还要通入空气,其目的是______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com