
分析 已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol、②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol、③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,根据盖斯定律③×2-②-①可得:2NO(g)+2CO(g)=N2(g)2CO2(g),反应热也进行相应计算,从而得出该热化学方程式.
解答 解:已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ/mol
③C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
根据盖斯定律③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),△H=2×(-393.5kJ/mol)-(-221.0kJ/mol)-180.5kJ/mol=-746.5kJ/mol,
反应热化学方程式为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol,
故答案为:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJ/mol.
点评 本题考查了盖斯定律在热化学方程式计算中的应用方法,题目难度中等,根据盖斯定律构造目标热化学方程式为解答关键,注意掌握盖斯定律的含义及应用方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-═Cl-+HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| C. | 石灰水中加入过量小苏打溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32+2H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 对CO(g)+NO2(g)═CO2(g)+NO(g)平衡体系增大压强可使其颜色变深 | |
| C. | 常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
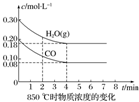 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物:空气、矿泉水、水银 | B. | 酸性氧化物:、CO2、SO2、CO | ||
| C. | 盐:醋酸钠、氯化铵、纯碱 | D. | 弱电解质:CH3COOH、H2O、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com