
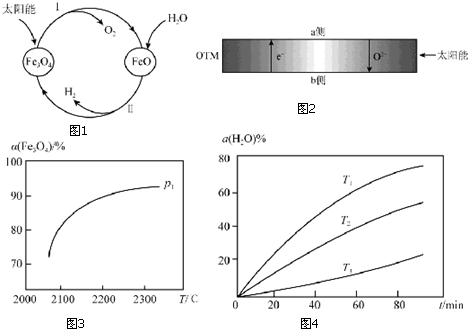
分析 (1)过程Ⅰ:2Fe3O4(s)?6FeO(s)+O2(g)△H=+313.18kJ•mol-1
①将O2分离出去,平衡正向移动,目的是提高Fe3O4的转化率;
②正反应是吸热反应,随着温度升高,平衡常数K 变大;
③压强增大,平衡向气体系数减小的方向移动,转化率降低;
(2)由图可知:过程Ⅱ的化学方程式是氧化亚铁与水蒸气反应生成四氧化三铁和氢气;
(3)可以从图象斜率看出速率大小,温度与速率呈现正相关,得到T1>T2>T3;
(4)本实验利用水制取氢气,H2O 得电子生成H2和O2-,O2-通过OTM 进入b 侧,所以H2O在a 侧,反应方程为H2O+2e-=H2+O2-.
解答 解:(1)过程Ⅰ:2Fe3O4(s)?6FeO(s)+O2(g)△H=+313.18kJ•mol-1
①将O2分离出去,平衡正向移动,目的是提高Fe3O4的转化率,故答案为:转化率;
②正反应是吸热反应,随着温度升高,平衡常数K 变大,故答案为:随着温度升高,平衡常数K 变大;
③压强增大,平衡向气体系数减小的方向移动,转化率降低,所以图象为: ,故答案为:
,故答案为: ;
;
(2)由图可知:过程Ⅱ的化学方程式是氧化亚铁与水蒸气反应生成四氧化三铁和氢气,所以反应方程式为:3FeO+H2O?Fe3O4+H2,故答案为:3FeO+H2O?Fe3O4+H2;
(3)T 1>T2>T3;初始压强相同,浓度相同,图象斜率T 1>T2>T3,温度越高,反应速率越大,则说明T 1>T2>T3,故答案为:T 1>T2>T3;温度越高,反应速率越大;
(4)本实验利用水制取氢气,H2O 得电子生成H2和O2-,O2-通过OTM 进入b 侧,所以H2O在a 侧,反应方程为H2O+2e-=H2+O2-,故答案为:a;H2O+2e-=H2+O2-.
点评 本题考查化学平衡影响因素分析,为高频考点,把握发生的反应、平衡影响因素为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(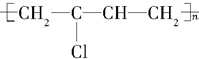 )的主要成分 )的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.
把除去氧化膜的镁条投入到盛有稀HCl的试管中,发现氢气发生的速率变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是不活泼的非金属元素,在自然界中可以以游离态的形式存在 | |
| B. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 | |
| C. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质不活泼 | |
| D. | 铝合金比纯铝的硬度更大、熔点更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在催化剂存在条件下苯与溴反应制溴苯 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 葡萄糖与银氨溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
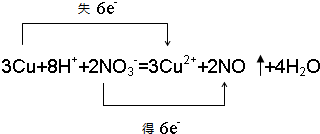 ,在这反应中该强酸展现酸性,氧化性.
,在这反应中该强酸展现酸性,氧化性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com