
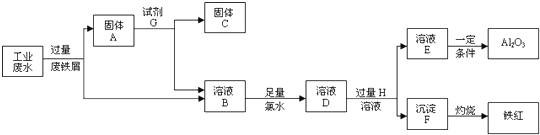
| ||
| ||


科目:高中化学 来源: 题型:
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:
| 浓H2SO4 |
| △ |
 +H2O
+H2O| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
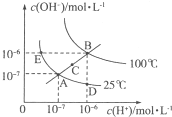 I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:
I.水的电离平衡曲线如图所示,根据图中数据,回答下列问题:| [OH-] |
| [NH3?H2O] |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A的分子式为C17H1803 |
| B、A的水解产物不少能发生聚合反应 |
| C、A不能使KMnO4的溶液褪色 |
| D、1mol与NaOH反应,最多消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫与水反应生成硫酸 |
| B、二氧化硫是酸性氧化物,能被氨水吸收 |
| C、二氧化硫是有毒气体,不能用于杀菌消毒 |
| D、正常雨水的pH为5.6,因为其中溶解了二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用图所示装置可制取Cl2 |
B、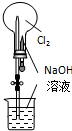 用图所示装置可完成“喷泉”实验 |
C、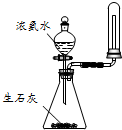 用图所示装置可制取并收集干燥纯净的NH3 |
D、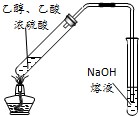 用图所示装置可用于实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已吸潮 |
| B、容量瓶未干燥 |
| C、烧杯内有少量NaOH溶液残留 |
| D、定容时俯视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Al3+、HCO3-、NO3- |
| B、AlO2-、Mg2+、H+、K+ |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、Na+、NO3-、ClO-、I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com