
【题目】下表是几种弱电解质的电离平衡常数 (25℃)。
电解质 | 电离方程式 | 平衡常数K |
CH3COOH | CH3COOH | 1.76 × 10 -5 |
H2CO3 | H2CO3 HCO3— | K1=4.31 × 10 -7 K2=5.61 × 10 -11 |
C6H5OH | C6H5OH | 1.1 × 10 -10 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.52 × 10 -3 K2=6.23× 10 -8 K3=2.20× 10 -13 |
NH3·H2O | NH3·H2O | 1.76× 10 -5 |
回答下列问题(C6H5OH为苯酚):
(1)由上表分析,若 ① CH3COOH ② HCO3— ③ C6H5OH ④ H2PO4— 均可看作酸,则它们酸性由强到弱的顺序为___________(填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:__________________________;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO—)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10 mL 0.01 mol/L苯酚溶液中滴加V mL 0.01 mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥ 10
B.若混合液pH<7,则c((NH4+) >c (C6H5O—) >c (H+)>c (OH—)
C.V=10时,混合液中水的电离程度小于10 mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式_______________。
【答案】 ①④③② C6H5OH + PO43—= C6H5O—+ HPO42— = D ![]()
【解析】(1). 根据表中数据可知,酸的电离平衡常数大小顺序是①④③②,酸的电离平衡常数越大,其酸性越强,所以它们的酸性由强到弱的是①④③②,故答案为:①④③②;
(2). 苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,小于磷酸的第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠,离子方程式为:C6H5OH + PO43—= C6H5O—+ HPO42—,故答案为:C6H5OH + PO43—= C6H5O—+ HPO42—;
(3). 25℃时,等体积等浓度的醋酸和氨水混合,二者恰好完全反应生成醋酸铵,由表中数据可知,醋酸和氨水的电离平衡常数相等,则醋酸根离子和铵根离子水解程度相等,所以醋酸铵溶液呈中性,c(OH)= c(H+),根据电荷守恒式c(OH)+c(CH3COO)=c(NH4+) +c(H+)可知, c(CH3COO)=c(NH4+),故答案为:=;
(4). 25℃时,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,A. 若混合液pH>7,则溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨,苯酚和氨水的浓度相等,要使溶液呈碱性,苯酚的体积小于或等于或大于氨水的体积都可能使混合溶液呈碱性,故A错误;B. 若混合液pH<7,溶液中的溶质为苯酚和苯酚铵,pH<7,则c(H+)>c(OH),溶液中存在电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(C6H5O)+c(OH),所以c(C6H5O)>c(NH4+),故B错误;C. 含有弱酸根阴离子或弱碱阳离子的盐促进水的电离,酸抑制水的电离,所以苯酚铵促进水的电离,苯酚抑制水的电离,因此V=10时,混合液中水的电离程度大于10 mL 0.01mol/L苯酚溶液中水的电离程度,故C错误;D. 任何电解质溶液中都遵循物料守恒,根据物料守恒得V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O—)+ c (C6H5OH),故D正确;答案选D;
(5). 碳酸根离子发生第一步水解反应的离子方程式为:CO32-+H2O![]() HCO3-+OH-,根据平衡常数的定义可知,Na2CO3第一步水解反应的水解常数的表达式为:
HCO3-+OH-,根据平衡常数的定义可知,Na2CO3第一步水解反应的水解常数的表达式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于图示四个装置的叙述不正确的是


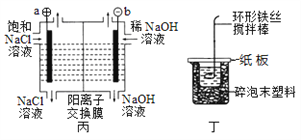
A. 装置甲是可以在铁钉上镀铜的装置
B. 装置乙若为电解精炼铜装置,则X电极为精铜
C. 装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D. 装置丁可用于测定化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
B. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D. 常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法不属于污水处理方法的是( )
A. 用蒸馏法制备纯净水
B. 用混凝法除去水中悬浮物颗粒
C. 用熟石灰处理电镀厂产生的酸性水
D. 用沉淀法除去水中的重金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-丁二烯和马来酸酐( )是重要的化工原料,可用于合成可降解的PBS塑料和衣康酸。
)是重要的化工原料,可用于合成可降解的PBS塑料和衣康酸。

已知:
(1)反应①的反应类型是_______________________。
(2)C的分子式是C4H4O4,是一种二元羧酸。C为顺式结构,结构简式是____________。
(3)反应②的化学方程式是__________________________________________________。
(4)E的分子式C6H8O4。
i.G的名称是________________。
ii.H的结构简式是____________________________。
(5)与衣康酸具有相同种类和数目的官能团的同分异构体的数目是_________(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对2-溴丙烷与NaOH溶液发生的反应进行探究,实验装置如下(夹持和加热装置已略去):

实验步骤:
ⅰ.将圆底烧瓶用水浴加热,冷凝管中通入冷凝水;
ⅱ.将分液漏斗中的2-溴丙烷与NaOH溶液的混合液滴入圆底烧瓶内。
(1)水冷凝管a口是__________(填“进水口”或“出水口”)。
(2)取具支试管中收集到的液体,经红外光谱检测,其中一种物质中存在C-O键和O-H键。则该物质的结构简式是_________________。
(3)实验中酸性KMnO4溶液褪色,生成该使酸性KMnO4溶液褪色的物质的反应的化学方程式是____________________________________________________________。
(4)通过该实验得到的结论是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯和苯三种有机物的共同点是
A. 都由C和H两种元素组成
B. 都能使酸性KMnO4溶液褪色
C. 都能发生加成反应和取代反应
D. 在O2中完全燃烧都生成CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
序号 | 实验操作 | 实验目的 |
① | 滴加酸性高锰酸钾溶液 | 确定苯中混有乙醛 |
② | 向水解后的蔗糖溶液中直接加入新制氢氧化铜悬浊液并加热 | 确定蔗糖是否水解 |
③ | 加入碳酸氢钠溶液 | 确定乙醇中混有乙酸 |
④ | 加淀粉 | 确定食盐中含有碘酸钾 |
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com