
| A. | 2Mg+SO2$\frac{\underline{\;△\;}}{\;}$2MgO+S | |
| B. | SO2+Br2+2H2O═2HBr+H2SO4 | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | SO2+2NaOH═Na2SO3+H2O |
科目:高中化学 来源: 题型:推断题
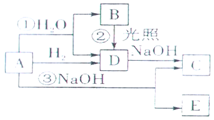 A是黄绿色气体单质,如图所示,
A是黄绿色气体单质,如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑦ | B. | ①②⑤⑦ | C. | ②④⑥ | D. | ②④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
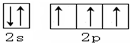 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀X的成分是SiO2 | |
| B. | 将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 | |
| C. | 在溶液Y中加入过量的NaOH溶液,过滤得到沉淀是Fe(OH)3 | |
| D. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||||
| Z | Y | M | N |
| A. | N的氧化物对应水化物的酸性一定比X的氧化物对应水化物的酸性强 | |
| B. | 相同条件下,与同浓度、同体积的盐酸反应,单质Z的反应速率大于单质Y | |
| C. | X的原子半径比Y的小 | |
| D. | X和M的原子序数相差10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
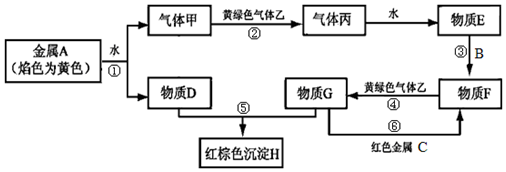
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将Al2(SO4)2、NaOH溶液相互滴加 | 鉴别Al2(SO4)3、NaOH溶液 |
| B | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
| C | 向NaHS溶液中滴入酚酞,溶液变红色 | HS-水解程度大于电离程度 |
| D | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液,均有沉淀 | 蛋白质均发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com