
| 实验目的 | 实验操作 | |
| A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液;
B.直接加热,易导致氯化镁水解;
C.二者都与稀硝酸反应;
D.分别将少量钠投入到盛有水和乙醇的烧杯中,可根据反应的剧烈程度比较氢的活泼性.
解答 解:A.将NaOH浓溶液滴加到饱和FeCl3溶液中,生成氢氧化铁沉淀,制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,故A错误;
B.氯化镁易水解,加热溶液易得到氢氧化镁沉淀,为防止水解,应在氯化氢氛围中,故B错误;
C.二者都与稀硝酸反应,应加入非氧化性酸,如稀硫酸或盐酸,故C错误;
D.分别将少量钠投入到盛有水和乙醇的烧杯中,可根据反应的剧烈程度比较氢的活泼性,故D正确.
故选D.
点评 本题考查较为综合,涉及胶体的制备、盐类的水解、除杂以及性质的比较等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 石油的蒸馏实验中,加入碎瓷片可防止石油在蒸馏时暴沸 | |
| B. | 乙醇的催化氧化实验中铜丝主要起氧化剂的作用 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入乙酸,最后加入浓硫酸 | |
| D. | 在淀粉溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明淀粉没有水解 | |
| E. | 除去甲烷中混有的少量乙烯,可以将混合气体通过酸性溶KMnO4液 | |
| F. | 用钠可以检验某无水酒精中是否含有水 | |
| G. | 可用溴水来鉴别植物油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
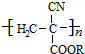 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下: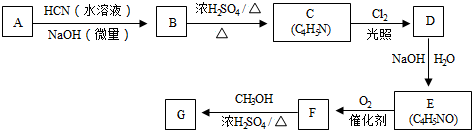
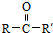 $→_{NaOH(微量)}^{HCN(水溶液)}$
$→_{NaOH(微量)}^{HCN(水溶液)}$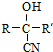
 .其核磁共振氢谱显示为2组峰,峰面积比为1:6.
.其核磁共振氢谱显示为2组峰,峰面积比为1:6. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气作水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 肥皂水作蚊虫叮咬处的清洗剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气比臭氧稳定 | |
| B. | 所有吸热反应不一定都要加热反应才能进行 | |
| C. | 断裂3mol氧气中的化学键吸收的能量大于形成2mol臭氧中的化学键放出的能量 | |
| D. | 3mol氧气的总能量比2mol臭氧的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
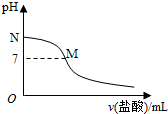
| A. | 该滴定过程应该选择酚酞作为指示剂 | |
| B. | M点对应的盐酸体积为20.0mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
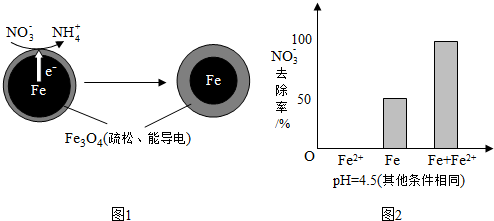
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 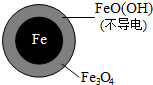 |  |
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化是物理变化 | |
| B. | 蛋白质的基本结构单元是氨基酸 | |
| C. | 在蛋白质溶液中加入CuSO4溶液,可使蛋白质的溶解度降低而析出 | |
| D. | 乙醛、葡萄糖、淀粉都能与新制的银氨溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高 | |
| C. | 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com