
(8分)已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ) ,反应过程中能量变化如下图: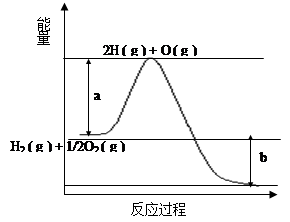
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应是 反应(填“吸热”或“放热”),△H (填“< 0”或“> 0”)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
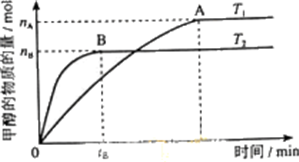
| 3nB |
| 2tB |
| 3nB |
| 2tB |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列表述正确的是( )
下列表述正确的是( )| A、使用催化剂可以改变一个反应的反应热,从而可以改变化学反应速率 | ||
| B、图中A、B面曲线分别表示合成氨反应使用和未使用铁触媒时,反应过程中的能量变化 | ||
C、已知H2(g)+
| ||
| D、若N2(g)+3H2(g)?2NH?(g)△H=-d kJ?mol??,故在某容器中投入1 mol N2与3 mol H2充分反应后放出的热量为d kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com