
【题目】Ⅰ.已知NO2和N2O4之间发生可逆反应:2NO2(g)(红棕色)![]() N2O4(g)(无色)
N2O4(g)(无色)
(1)在烧瓶A和B中盛有相同浓度的NO2与N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。

分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中____。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生_____。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
Ⅱ.某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
(2)对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。

在OA、AB、BC三段中反应速率最快的是__,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。
【答案】B中红棕色变浅 化学平衡的移动 a c e 5 固体反应物的表面积 AB 0.06mol·L-1·min-1
【解析】
Ⅰ.(1)浓硫酸的稀释是放热过程,硝酸铵的溶解过程是吸热过程,结合勒夏特列原理可知;
(2)在2NO2(g)(红棕色)![]() N2O4(g)(无色)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物、生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项;
N2O4(g)(无色)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,反应物、生成物的物质的量不再改变,曲线为水平直线,以此判断题中各项;
Ⅱ. (1)第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池;
(2)1和2除固体表面积不同外,其它因素相同;
(3)速率=浓度变化量/时间。
Ⅰ.(1)浓硫酸的稀释是放热过程,硝酸铵的溶解过程是吸热过程,所以盛有浓硫酸的烧杯中溶液温度升高、溶解硝酸铵的烧杯中溶液温度降低,A中气体颜色加深,说明正反应是放热反应,降低温度平衡正向移动,所以B中红棕色变浅。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生化学平衡的移动;
(2)a.t1时,反应未达到平衡,正反应速率大于逆反应速率,所以平衡正向移动,则NO2浓度在减小,故a正确;
b.t2时,正逆反应速率相等,所以反应达到平衡,反应仍然进行,为动态平衡状态,故b错误;
c.t2~t3,正逆反应速率相等,反应达到平衡状态,所以各物质浓度不再变化,故c正确;
d.t2~t3,正逆反应速率相等,反应达到平衡状态,所以各物质浓度不再变化,但各物质的浓度不相等,故d错误;
e.0~t2,正反应速率大于逆反应速率,平衡正向移动,则N2O4浓度增大,故e正确;
f.反应过程中气体的颜色变浅,达到平衡后颜色不再改变,故f错误;
答案选ace;
Ⅱ. (1)第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池,因此反应速率最快,锌完全消失所需的时间最短;
(2)1和2除固体表面积不同外,其它因素相同,是考查固体反应物的表面积对速率的影响;
(3)从图中看出2-4分钟内产生氢气最多,故AB这段时间内反应速率最大;
2-4分钟内,产生氢气179.2mL-44.8mL=134.4mL,物质的量为![]() =6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)
=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为:6×10-3mol,v(H2SO4)![]() =0.06molL-1min-1。
=0.06molL-1min-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的有( )
①![]()
②![]()
③上述溶液中加入V mL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的叙述正确的是( )
A. 碱金属单质均为银白色,密度均小于水
B. 碱金属单质从Li到Cs,熔点依次升高
C. 氢氧化铯碱性强于氢氧化钠
D. 碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去,
方案②:B中加入KSCN溶液,溶液不变血红色,再加入新制的氯水,溶液变血红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
(1)上述实验方案中能证明该反应液有Fe2+生成的是_____________。
Ⅱ.氨气具有还原性,在加热时与氧化铜发生反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
某化学实验小组拟用下列仪器(可重复使用)证明氨气具有还原性,并检验生成的水。现提供浓氨水、氧化铜,若需其他试剂可自选。(连接和固定仪器用的胶管、铁夹、铁架台等装置均略去),请回答下列问题:
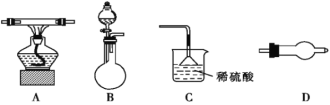
(2)上述仪器从左到右的连接顺序是__→D→__→D→__(填字母)。____________
(3)烧瓶中加入的固体试剂可以是___。
①生石灰 ②五氧化二磷 ③硫酸铜 ④氢氧化钠
(4)装置C中倒扣漏斗的作用是__________________。
(5)需重复使用的仪器D中所选用的固体药品依次是_____。
(6)实验中证明有水生成的现象是_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)、按要求填空:
①、第三周期中有两个成单电子的元素符号是__________。
②、四核10电子的粒子的电子式(写一种)__________。
③、第四周期中,3d轨道半充满的元素符号是__________。
(2)、写出符合下列条件的元素原子的电子排布式:
①、自然界中含量居第二的金属元素__________。
②、第四周期0族元素__________。
③、能形成自然界中最硬的单质的元素__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A. pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D. 向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置在中学实验中有很多用途,可根据实验目的在广口瓶中盛放适量某试剂。下面有关其使用有误的是( )

A. 瓶内装饱和食盐水,可用于除去氯气中的HCl气体,气体应a进b出
B. 瓶内装水,可用于除去NO气体中的NO2气体,气体应a进b出
C. 瓶口朝上,可用于收集NH3,气体应b进a出
D. 瓶口朝下,可用于收集CH4气体,气体应b进a出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com