
��6�֣���֪����SO2ͨ��FeCl3��Һ�У���Һ��ɫ���Ϊdz��ɫ����ԭ���ɱ�ʾΪ��
��Fe3������SO2 ����H2O ���� ��Fe2������SO42������H��
(1)����ƽ�������ӷ���ʽ��
(2)���μӷ�Ӧ��SO2�ڱ�״���µ����Ϊ1.12 L����÷�Ӧת�Ƶĵ��ӵ����ʵ���Ϊ_______mol��
(3)��֪��Fe2����Һ�еμ���������ʱ����Һ��dz��ɫ��Ϊ��ɫ����Fe3����SO42-��HNO3��������ǿ��˳��Ϊ____________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?������ģ�����п�ͼ���漰����������ѧ��ѧ�����ģ����ת����ϵ��ͼ��ʾ����֪������A�ڵ���G����ȼ�գ����������ˮ��L�����嵥C������B��ȼ�գ�A��B��Gͨ��Ϊ��̬���ʣ���ش��й����⣺
��2010?������ģ�����п�ͼ���漰����������ѧ��ѧ�����ģ����ת����ϵ��ͼ��ʾ����֪������A�ڵ���G����ȼ�գ����������ˮ��L�����嵥C������B��ȼ�գ�A��B��Gͨ��Ϊ��̬���ʣ���ش��й����⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-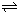 C2D4��g������H��0���ں��º��������£���һ����CD2��C2D4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
C2D4��g������H��0���ں��º��������£���һ����CD2��C2D4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��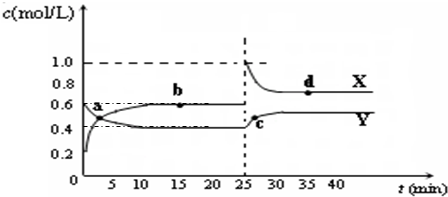
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� | �� Ϣ |
| 1 | DΪ�ؿ��к�����ߵ�Ԫ����ɵĵ��� |
| 2 | EΪ���������������ˮ������ij���ᷴӦ |
| 3 | F������ˮ��F�����Ʊ�������Լ����������� |
| 4 | HΪ����ɫ���廯���� |
| 5 | ��ⱥ��J��Һ�ǹ�ҵ�����е���Ҫ��Ӧ |
| 6 | CΪ���ӻ�������������Ӿ����н���Ԫ�� |
| 7 | KΪ�������Ҫ�ɷ� |
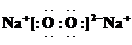
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ������
 SO3(g)��H=-98 kJ/mol����ʼʱ��100 L���ܱ������м���4.0 mol SO2(g)��10.0 mol O2(g)������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=_________��
SO3(g)��H=-98 kJ/mol����ʼʱ��100 L���ܱ������м���4.0 mol SO2(g)��10.0 mol O2(g)������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=_________��  2SO3(g)���ﵽƽ��ı�����������SO2��O2��SO3��ƽ��Ũ�ȶ���ԭ���������_______������ĸ����
2SO3(g)���ﵽƽ��ı�����������SO2��O2��SO3��ƽ��Ũ�ȶ���ԭ���������_______������ĸ���� 
 2SO3(g)��Ӧ��ͼ���У���ȷ����______________��
2SO3(g)��Ӧ��ͼ���У���ȷ����______________�� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com