
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
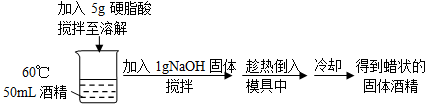
| A. | 将酒精加热到60℃的目的是使更多的硬脂酸溶解在其中 | |
| B. | 上述过程中,有酸碱中和反应发生 | |
| C. | 上述过程中,加入NaOH发生皂化反应 | |
| D. | 常温下,硬脂酸钠在酒精中的溶解度小于在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯催化加氢后得到3,3-二甲基-丁烷 | |
| B. | 2-甲基-1,3-丁二烯与Br2的加成产物有3种 | |
| C. | 根据所有原子不在同一平面上可以说明C4H6的某烃是1-丁炔而不是CH2=CH-CH=CH2 | |
| D. | 已知具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
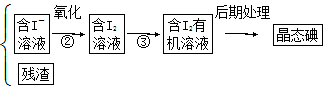
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液的溶质质量分数变大 | B. | 溶液仍为饱和溶液 | ||
| C. | 溶液中的Na+数目减小 | D. | 溶液中的c(Na+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com