
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2 HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O+CO32-═H2CO3+2 HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
分析 碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,据此分析解答.
解答 解:碳酸存在电离平衡H2CO3?HCO3-+H+,K1=4×10-7,HCO3-?H++CO32- K2=5.6×10-11,
亚硫酸存在电离平衡 H2SO3?HSO3-+H+,K1=1.54×10-2,HSO3-?H++SO32- K2=1.02×10-7,
碳酸与亚硫酸都是弱酸,电离平衡常数越大,酸性越强,酸性强弱为:H2SO3>H2CO3>HSO3->HCO3-,发生化学反应应遵循强酸制备弱酸的原理,
A.H2SO3>HCO3-,符合强酸制弱酸,故A合理;
B.H2CO3可与SO32-反应得到HSO3-,故B不合理;
C.H2CO3与HSO3-能共存,故C合理;
D.HCO3-与HSO3-能共存,故D合理;
故选B.
点评 题目考查了离子反应发生的条件和弱电解质电离程度大小,明确电离平衡常数与酸性强弱关系、强酸制取弱酸原理是解本题关键,知道哪些物质之间能反应,哪些微粒之间能共存,为易错题.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:填空题
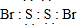 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时18 g水 | |
| B. | 标准状况下含6.02×1023个原子的Cl2 | |
| C. | 标准状况下1 mol氨气 | |
| D. | 常温常压下44 g二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 8个 | D. | 12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液一定呈酸性 | |
| B. | 该溶液中c(H+)可能等于10-5 mol•L-1 | |
| C. | 该溶液的pH可能为4也可能为10 | |
| D. | 该溶液有可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;其最外层共有6种不同运动状态的电子;
;其最外层共有6种不同运动状态的电子;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+2H2═CH3OH | B. | CaCO3+2HCl═CaCl2+CO2↑+H2O | ||
| C. | 2H2+O2═2H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com