
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaOH溶液:Na+、K+、![]() 、
、![]()
B.0.1mol·L-1Fe2(SO4)3溶液:Cu2+、![]() 、SCN-、
、SCN-、![]()
C.0.1mol·L-1Na2S溶液:Na+、K+、ClO-、OH-
D.0.1mol·L-1NH4HCO3溶液:Ba2+、K+、OH-、![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g) ΔH 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
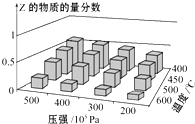
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.ΔH>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知有机物A、B、C、D、E有如图的转化关系,又知C不能发生银镜反应,E能发生银镜反应,则A结构可能有
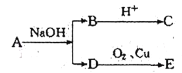
A.5种B.6种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min B的浓度减少0.6 molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 molL-1min-1
B.2min末的反应速率v(C)=0.2 molL-1min-1
C.2min内D的物质的量增加0.2mol
D.若起始时A、B的物质的量之比为4∶3,则2 min末A、B的转化率之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是( )
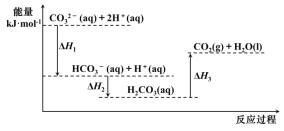
A.反应![]() (aq)+H+(aq)═CO2(g)+H2O(l) △H>0
(aq)+H+(aq)═CO2(g)+H2O(l) △H>0
B.![]() (aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
(aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
C.△H1>△H2,△H2<△H3
D.H2CO3(aq)═CO2(g)+H2O(l),若使用催化剂,则△H3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电钠-CO2 电池示意图如下,放电时电池总反应为: 4Na+3CO2=2Na2CO3+C.下列说法正确的是
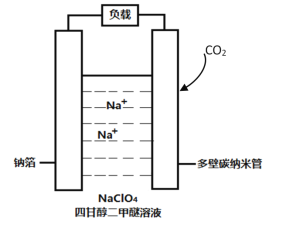
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++ 3CO2+ 4e- = 2Na2CO3+C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1molCO2,理论上电路中转移4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
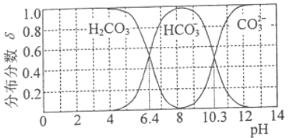
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
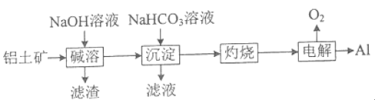
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
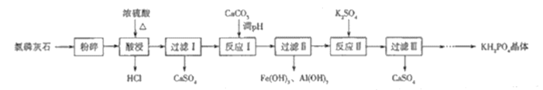
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
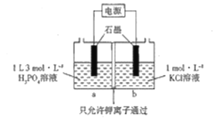
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com