
| A. | CO2的水溶液导电能力很弱,所以CO2是弱电解质 | |
| B. | 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 | |
| C. | 在水溶液中能离解为自由移动的离子的化合物是电解质 | |
| D. | 在强电解质的水溶液中只有离子没有分子 |
分析 A、二氧化碳不电离,二氧化碳和水反应生成碳酸发生部分电离;
B、硫酸钡难溶于水,但它是强电解质,乙酸易溶于水,但它是弱酸;
C、电解质是在水溶液中或熔融状态下完全电离的化合物;
D、水溶液中存在水分子,据此解答即可.
解答 解:A、CO2溶于水和水结合成碳酸,碳酸发生部分电离,碳酸是弱电解质,二氧化碳是非电解质,故A错误;
B、强弱电解质和溶于水的电解质是否完全电离有关,与是否难易溶于水无关.硫酸钡难溶于水,但它是强电解质,乙酸易溶于水,但它是弱酸,故B错误;
C、在水溶液中能离解为自由移动的离子的化合物是电解质,故C正确;
D、水溶液中存在水分子,故D错误,故选C.
点评 本题考查了强、弱电解质的判断,抓住强弱电解质的电离程度是解答本题的关键.难度不大.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
| 电负性 离子半径 键的极性 | 熔点 |
| N<O O2->Al3+ C-H<H-O | Al<Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和苯酚均无毒,但都能用于消毒、杀菌 | |
| B. | 乙醇和苯酚均能和金属Na反应置换出氢气 | |
| C. | 苯酚能与甲醛反应制造酚醛树脂 | |
| D. | 乙醇的沸点比乙烷高是因为乙醇分子间可以形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
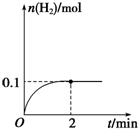 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
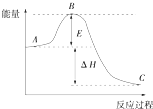 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
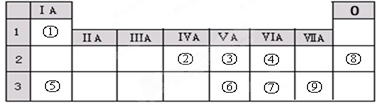
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com