

 Cr2O72-+H2O
Cr2O72-+H2O

 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 CH3OH(g) ��H1����116 kJ��mol-1
CH3OH(g) ��H1����116 kJ��mol-1| A����ʱ��CH3OH�뷴Ӧ�������� |
| B�����ͷ�Ӧ�¶� |
| C��������ϵѹǿ |
| D��ʹ�ø�Ч���� |


 CH3OH(g) ��ƽ�ⳣ��K = ��
CH3OH(g) ��ƽ�ⳣ��K = ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3CH2OH(g)+H2O(g) ��H=��256.1kJ��mol��1��
CH3CH2OH(g)+H2O(g) ��H=��256.1kJ��mol��1�� CO2(g)+H2(g) ��H=��41.2kJ��mol��1
CO2(g)+H2(g) ��H=��41.2kJ��mol��1 CH3CH2OH(g)+3H2O(l) ��H= ��
CH3CH2OH(g)+3H2O(l) ��H= �� CO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���
CO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�����±���| �¶�/�� | 800 | 1000 | 1200 | 1400 |
| ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
 CO+3H2��ƽ�ⳣ��K= ��
CO+3H2��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���·���������ԭ�Ӷ��ﵽ8���ӵ��ȶ��ṹ |
| B����-����ȼ�ϵ�أ������ĵ缫��ӦΪ��O2 +2H2O+4e-=4OH- |
| C����ȼ�յ��Ȼ�ѧ����ʽΪ��N2H4(g)+O2(g) = N2(g) +2H2O(g)����H=-642 kJ��mol-1 |
| D���·е�ߴ�l13�棬���Ʋ��·��Ӽ���γ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
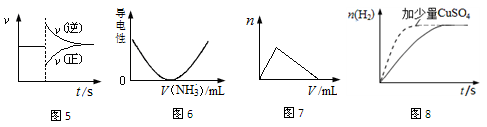
| A��ͼ5���Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ���ʵı仯 |
| B��ͼ6���Ա�ʾ������Һ��ͨ�백����������������Һ�����Եı仯 |
| C��ͼ7���Ա�ʾ��������Һ�еμ�����������Һ�����������ı仯 |
| D��ͼ8���Ա�ʾ����п����ϡ���ᷴӦ��������CuSO4�������H2�ı仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 +
+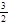
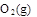 =
= 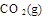 + 2
+ 2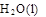 ��H = ��725.5 kJ��mol��1
��H = ��725.5 kJ��mol��1
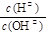 = 1��10�� 6 �������Һ��pHΪ____����Һ�е����ʵ������������Ũ��ԼΪ ���� pH = 4��������ҺV1 L�� 0.01 mol��L��1��ˮV2 L��ϣ��������ҺpH = 7����V1��V2�Ĺ�ϵΪ��V1 V2���>������<����=������
= 1��10�� 6 �������Һ��pHΪ____����Һ�е����ʵ������������Ũ��ԼΪ ���� pH = 4��������ҺV1 L�� 0.01 mol��L��1��ˮV2 L��ϣ��������ҺpH = 7����V1��V2�Ĺ�ϵΪ��V1 V2���>������<����=�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)
CH3OH(g) CO+3H2��Ϊ����ϳ�����H2������CO��������⣬ԭ������������CO2��CO3+H2=CO+H2O��Ϊ��ʹ�ϳ��������ѣ�������ԭ�����м����������̼�����Ϊ____________________________________��
CO+3H2��Ϊ����ϳ�����H2������CO��������⣬ԭ������������CO2��CO3+H2=CO+H2O��Ϊ��ʹ�ϳ��������ѣ�������ԭ�����м����������̼�����Ϊ____________________________________�� �����������仯����ͼ��ʾ��д���ϳɼ״����Ȼ�ѧ����ʽ__________________��
�����������仯����ͼ��ʾ��д���ϳɼ״����Ȼ�ѧ����ʽ__________________��
 ��300��ʱ��Ӧ��ʼ10�����ڣ�H2��ƽ����Ӧ����Ϊ__________��
��300��ʱ��Ӧ��ʼ10�����ڣ�H2��ƽ����Ӧ����Ϊ__________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��ͼ�ٱ�ʾ���淴ӦCO(g)+H20(g) 5C02 (g)+H2 (g)��H>0 5C02 (g)+H2 (g)��H>0 |
B��ͼ�ڱ�ʾѹǿ�Կ��淴Ӧ2A(g)+2B(g)  3C(g)+D(s)Ӱ�죬�ҵ�ѹǿ�� 3C(g)+D(s)Ӱ�죬�ҵ�ѹǿ�� |
| C��ͼ�۱�ʾ��������ѧ��Ӧ�������仯 |
| D��ͼ�ܱ�ʾC02ͨ�˱���̼������Һ�У���Һ�����Ա仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
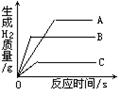
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com