
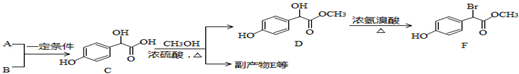
 ;
;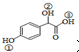 )中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②;
)中①、②、③3个-OH的酸性由强到弱的顺序是③>①>②; .
.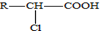 .A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5.
.A有多种合成方法,请写出由乙酸合成A的路线流程图(其他原料任选),合成路线流程图示例如下:H2C=CH2$→_{催化剂,△}^{H_{2}}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOC2H5. 分析 (1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应;
,A+B→C发生加成反应;
(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基;
(3)C中有羟基和羧基,2分子C可以发生酯化反应,可以生成3个六元环的化合物,C分子间醇羟基、羧基发生酯化反应,则E为 ;
;
(4)对比D、F的结构,可知溴原子取代-OH位置;F中溴原子、酚羟基、酯基(羧酸与醇形成的酯基),都可以与氢氧化钠反应;
F的所有同分异构体符合:①属于一元酸类化合物,②苯环上只有2个取代基且处于对位,其中一个是羟基,另外取代基为-CBr(CH3)COOH、-CH(CH2Br)COOH、-CH2CHBrCOOH、-CHBrCH2COOH;
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH.
解答 解:(1)A的分子式为C2H2O3,可发生银镜反应,且具有酸性,含有醛基和羧基,则A是OHC-COOH,根据C的结构可知B是 ,A+B→C发生加成反应,反应方程式为:
,A+B→C发生加成反应,反应方程式为: ,
,
故答案为:醛基、羧基; ;
;
(2)羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基,故强弱顺序为:③>①>②,
故答案为:③>①>②;
羧基的酸性强于酚羟基,酚羟基的酸性强于醇羟基;
(3)C中有羟基和羧基,2分子C可以发生酯化反应,可以生成3个六元环的化合物,C分子间醇羟基、羧基发生酯化反应,则E为 ,为对称结构,分子中有4种化学环境不同的H原子,分别为苯环上2种、酚羟基中1种、亚甲基上1种,
,为对称结构,分子中有4种化学环境不同的H原子,分别为苯环上2种、酚羟基中1种、亚甲基上1种,
故答案为:4;
(4)对比D、F的结构,可知溴原子取代-OH位置,D→F的反应类型是:取代反应;F中溴原子、酚羟基、酯基(羧酸与醇形成的酯基),都可以与氢氧化钠反应,1molF最多消耗3mol NaOH;
F的所有同分异构体符合:①属于一元酸类化合物,②苯环上只有2个取代基且处于对位,其中一个是羟基,另外取代基为-CBr(CH3)COOH、-CH(CH2Br)COOH、-CH2CHBrCOOH、-CHBrCH2COOH,可能的结构简式为: ,
,
故答案为:取代反应;3; ;
;
(5)由题目信息可知,乙酸与PCl3反应得到ClCH2COOH,在氢氧化钠水溶液、加热条件下发生水解反应得到HOCH2COONa,用盐酸酸化得到HOCH2COOH,最后在Cu作催化剂条件下发生催化氧化得到OHC-COOH,合成路线流程图为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH,
故答案为:CH3COOH$→_{△}^{PCl_{3}}$ClCH2COOH$→_{△}^{NaOH/H_{2}O}$HOCH2COONa$\stackrel{HCl}{→}$HOCH2COOH$→_{△}^{O_{2}/Cu}$OHC-COOH.
点评 本题考查有机物的推断与合成、同分异构体的书写、常见有机反应类型、官能团的性质等,是对有机化学基础的综合考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3可以除去酸性废水中的悬浮颗粒 | |
| B. | 高锰酸钾溶液和双氧水进行环境消毒时原理是相同的 | |
| C. | 雾霾中含有大量超标的主要物质是SO2 | |
| D. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| C. | $\frac{1}{18}$mol的H37Cl分子所含中子数为NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸的反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH═-NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “钴酞菁”分子所形成的分散系不具有丁达尔效应 | |
| B. | “钴酞菁”分子不能透过滤纸 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com