
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
分析 A、第二周期中,O、F没有正价;
B、同一周期从左到右,元素的金属性逐渐减弱、非金属性逐渐增加;
C、IA族包含碱金属与氢元素;
D、位于金属与非金属分界线附近的元素既有金属性也有非金属性.
解答 解:A.第二周期元素中氧元素无最高正价,氟元素没有正价,故A错误;
B、同一周期从左到右,元素的金属性逐渐减弱、非金属性逐渐增加,故B错误;
C、IA族包含碱金属与氢元素,氢元素属于非金属元素,故C错误;
D、位于金属与非金属分界线附近的元素既有金属性也有非金属性,所以可在金属与非金属分界线附近寻找半导体材料,故D正确;
故选D.
点评 本题考查元素周期表的结构,比较基础,旨在考查学生对基础知识的掌握.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| B. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 | |
| C. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 含1mol[Co(NH3)5Cl]Cl2的溶液与足量的AgNO3溶液混合,能生成2mol的AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的结构简式:C2H2 | |
| B. | S2-的结构示意图: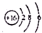 | |
| C. | 甲烷分子的球棍模型 | |
| D. | 硫酸钠的电离方程式:Na2S04=2Na++S042- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗2n molSO2的同时生成2n molS03,说明该反应达到平衡状态 | |
| B. | 达到化学平衡时,SO2、02和SO3的物质的量浓度均保持不变 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,SO2将完全转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | 单位时间里每增加1molN2,同时减少2mol NH3 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 分离出HI | C. | 充入H2 | D. | 充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
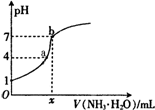 向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示.下列判断正确的是( )| A. | x=20 | B. | 稀H2SO4的浓度为0.10mol/L | ||
| C. | b点有:2c(NH4+)=c(SO42-)>c(H+)=c(OH-) | D. | a点有:c(NH4+)<2c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com