
| A. | 中国古代利用明矾的溶液的酸性清除铜镜表面的铜锈 | |
| B. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| C. | 14C可用于文物年代的鉴定,14C与12C互为同位素 | |
| D. | 喝补铁剂时,加服维生素C效果更好,原因是维生素C具有还原性 |
分析 A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液;
B.二氧化硫具有漂白性,可以选择性漂白有机色素,二氧化硫有毒,不能用于食品添加剂,不能漂白食物;
C.质子数相同中子数不同的同种元素的不同原子互称同位素;
D.能被人体吸收的铁元素是亚铁离子,容易被氧化,维生素C具有还原性,可以防止亚铁离子被氧化.
解答 解:A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.二氧化硫具有漂白性,结合有色物质形成不稳定的无色物质,可以用来漂白纸浆、毛、丝、草帽辫等,但二氧化硫是有毒气体,不能漂白食品,故B错误;
C.14C的应用主要有两个方面:一是在考古学中测定生物死亡年代,即放射性测年法,二是以14C标记化合物为示踪剂,12C和14C质子数相同中子数不同,互为同位素,故C正确;
D.能被人体吸收的铁元素是亚铁离子,亚铁离子很容易被氧化为三价铁离子,维生素C具有还原性,能将三价铁还原为亚铁离子,故D正确;
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 阴阳两极都是石墨 | B. | 铜作阳极,铁作阴极 | ||
| C. | 铁作阳极,铜作阴极 | D. | 铜作阳极,铂作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝投入到氢氧化钠溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
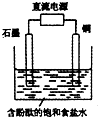
| A. | 铜电极上发生还原反应 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 溶液中的Na+向石墨电极移动 | D. | 铜电极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
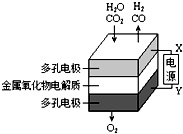 在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O~CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
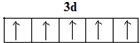 .
.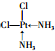 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com