
【题目】按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是( )

A. (CH3)3COH (气)B. NH3C. CH3CH2CH2OH(气)D. CO和H2
【答案】C
【解析】
a处有红色物质生成,说明氧化铜被还原有铜生成;b处变蓝,说明反应中有水生成;c处得到液体,说明该反应生成的气体产物中易液化,遇到冰水混合物会变为液体,综上所述说明X物质具有还原性、且X和CuO反应生成水,且该反应生成的气体产物中易液化,据此分析作答。
根据上述分析可知:
A. (CH3)3COH(气),连接羟基的C原子上没有H原子,不能被氧化铜催化氧化,A项错误;
B. 氨气虽然也能还原CuO,生成H2O和N2,但是冰水冷却时,不能得到液体,B项错误;
C. 丙醇气体可以还原氧化铜,产物为水和丙醛,水使b处变蓝,丙醛在c处冷凝得到液体,C项正确;
D. 一氧化碳和氢气的混合气体这两种可以还原氧化铜,产物为二氧化碳和水,可以使b处变蓝,但是无法在c处产生液体,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】室温下,向a点(pH=a)的20.00mL 1.000molL-1氨水中滴入1.000molL-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )

A.将此氨水稀释,溶液的导电能力减弱
B.b点溶液中离子浓度大小可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c点时消耗盐酸体积V(HCl)<20.00mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应C(s)+H2O(g)![]() CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
CO(g)+H2(g)在密闭容器中进行,一段时间后达到平衡,下列措施不能使平衡发生移动的是( )
①增加C的物质的量 ②保持体积不变,充入N2使体系压强增大 ③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组同学用如图装置进行实验,试回答下列问题:
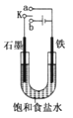
①若开关K与a连接,则铁发生电化学腐蚀中的_____腐蚀,石墨电极上的电极反应式为_____。
②若开关K与b连接,则电解反应的化学方程式为_____。
(2)该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如下图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为_____。
此时通过阴离子交换膜的离子数_____(选填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
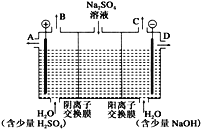
②通电开始后,阴极附近溶液pH_____(选填“增大”、“不变”或“减小”)。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_____;已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g 液态H2O时,理论上有_____kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是
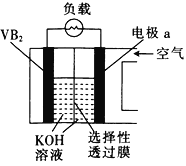
A. 电极a的电势比VB2极的高
B. VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C. 放电时,OH-由VB2极向a电极移动
D. 若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体:2CO(g)+2NO(g)![]() 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
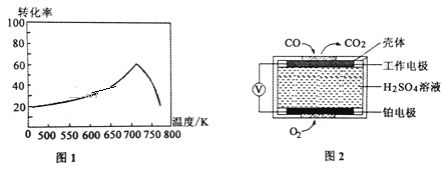
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) ![]() CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com