
| A. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| B. | 水汽化需要吸收能量,所以水汽化属于吸热反应 | |
| C. | 所有的化合反应都是放热反应 | |
| D. | 1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 |
分析 A.旧键断裂吸收能量,新键形成放出能量;
B.吸热反应属于化学反应;
C.化合反应有的是吸热反应;
D.中和热是指稀的强酸溶液和稀的强碱溶液发生中和反应,生成1mol水放出的热量.
解答 解:A.旧键断裂吸收能量,新键形成放出能量,化学反应有化学键的断裂和形成,都伴有能量变化,故A正确;
B.吸热反应属于化学反应,水汽化属于物质状态之间的转化是物理变化,所以水汽化不属于吸热反应,故B错误;
C.碳与二氧化碳反应生成是吸热反应,故C错误;
D.1mol硫酸含2mol氢离子和足量强碱反应生成2mol水,因此放出的热量不是中和热,故D错误.
故选A.
点评 本题考查了化学反应中能量的变化、中和热的概念,注意化学反应中能量变化的原因,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L苯中约含有3.612×1023个碳原子 | |
| B. | 常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 1L 1mol/L醋酸溶液中离子总数为1.204×l024 | |
| D. | 0.5mol CH4中约含有3.01×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
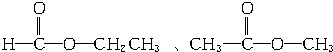 、
、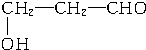 、
、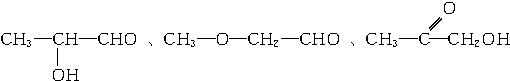 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
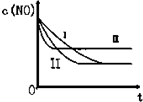 汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
汽车尾气中的主要污染物是NO和CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(NO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/10-3mol•L-1 | CO初始浓度/10-3mol•L-1 | 催化剂的比表面积/m2•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| ① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| ③ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
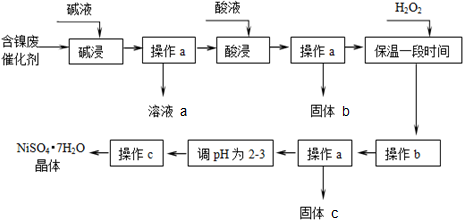
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com