
【题目】硼的化合物或合金在储氢、有机合成、超导等方面用途非常广泛。
(1)Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为___。
(2)与环硼氮六烷[分子式为(HNBH)3]互为等电子体的常见分子是___(填结构简式);推测环硼氮六烷在热水、CH3OH中的溶解性:__(填“难”或“易”)溶于热水、CH3OH。
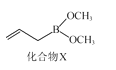
(3)化合物X(如图所示)可由CH2CHCH2MgBr与B(OCH3)3制备。X分子中碳原子的轨道杂化类型为___;1molX分子中含σ键数目为____。
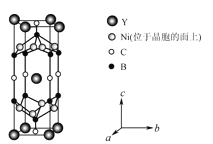
(4)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图所示,则其化学式为___。
【答案】[Ar]3d5或1s22s22p63s23p63d5 ![]() 易 sp2和sp3 18mol YNi2B2C
易 sp2和sp3 18mol YNi2B2C
【解析】
根据Mn原子的电子排布式分析;根据等电子体原理判断;根据价层电子对数目和价层电子寻互斥理论分析原子的杂化类型;根据晶胞结构分析晶体的化学式。
(1)Mn的核电荷数为25,其电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2,则Mn2+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5;
(2)环硼氮六烷[分子式为(HNBH)3],分子内12个原子,价电子总数为,30,则与环硼氮六烷互为等电子体的常见分子是C6H6,其结构简式为![]() ;环硼氮六烷分子中N原子非金属性强,能与水或CH3OH之间形成氢键,不溶于冷水,但易溶于热水和CH3OH;
;环硼氮六烷分子中N原子非金属性强,能与水或CH3OH之间形成氢键,不溶于冷水,但易溶于热水和CH3OH;
(3)化合物X中碳碳双键上碳原子杂化轨道方式为sp2杂化,而其余碳原子杂化轨道方式为sp3杂化;单键均为σ键,碳碳双键中有1个σ键,则1molX分子中含σ键数目为18mol;
(4)YxNiyBzCw晶胞中Y原子数为8×![]() +1=2,Ni原子数为=8×
+1=2,Ni原子数为=8×![]() =4,B原子数8×
=4,B原子数8×![]() +2=4,C原子数为4×
+2=4,C原子数为4×![]() +2×
+2×![]() =2,四种原子的数目比依次为1:2:2:1,则其化学式为YNi2B2C。
=2,四种原子的数目比依次为1:2:2:1,则其化学式为YNi2B2C。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A. 收集氯气用排饱和食盐水的方法
B. 加压条件下有利于SO2和O2反应生成SO3
C. 将NO2球浸泡在热水中颜色加深
D. 加催化剂,使N2和H2在一定的条件下转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的△H也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是

A. ①中溶液橙色加深,③中溶液变黄
B. ②中Cr2O72-被C2H5OH还原
C. 对比②和④可知K2Cr2O7酸性溶液氧化性强
D. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A. 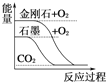 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应
B. 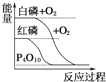 白磷比红磷稳定
白磷比红磷稳定
C. 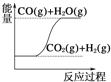 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
D. 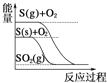 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如图:
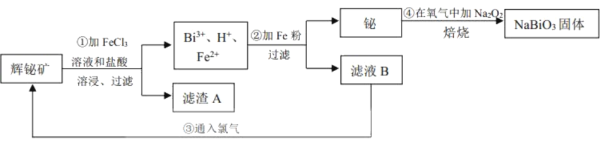
己知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有___(填标号)。
a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是___,滤渣A的主要成分为___(填化学式)。
(3)反应④的化学方程式为___。
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO![]() ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___。
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要___。
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为___%(结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是

A.反应的化学方程式为![]()
B.![]() 时,Y的浓度是X浓度的
时,Y的浓度是X浓度的![]() 倍
倍
C.根据![]() 时的数据,可求出该温度下的平衡常数
时的数据,可求出该温度下的平衡常数
D.![]() 时,逆反应速率大于正反应速率
时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
)常用作医药中间体,用于有机合成。1,3—环己二酮的一种合成路线如图所示。
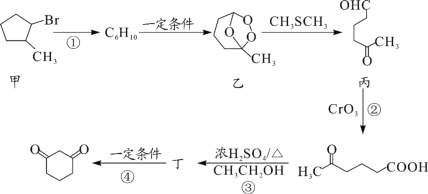
回答下列问题:
(1)甲的分子式为___。
(2)丙中含有官能团的名称是___。
(3)反应①所需的试剂和条件是___;②的反应类型是___。
(4)丁的结构简式为___。
(5)写出丙与新制氢氧化铜悬浊液反应的化学方程式___。
(6)符合下列条件的乙的同分异构体共有___种。
①能发生银镜反应
②能与NaHCO3溶液反应
其中核磁共振氢谱峰面积之比为1∶1∶2∶6的一种同分异构体的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的产量能衡量一个国家石油化工发展水平,F的碳原子数为D的两倍,以A为原料合成F,其合成路线如图所示:
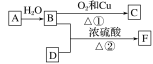
(1)写出决定B、D性质的重要原子团的名称:
B________、D________。
(2)A的结构式为____________。
(3)写出下列反应的化学方程式并注明反应类型:
①______________________________________________,反应类型:__________;
②______________________________________________,反应类型:__________。
(4)实验室怎样区分B和D?_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com