
实验室需配置100mL2.00mol/LNaCl溶液,请你参与实验过程,并完成相关实验报告(填写表格中横线上数字序号所示内容)。
实验原理 | m=cVM |
实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL ① 、胶头滴管 |
实验步骤 | (1)计算:溶质NaCl固体的质量为 ② g。 (2)称量:用托盘天平称取所需NaCl固体。 (3)溶【解析】 (4)转移、洗涤:将烧杯中的溶液注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中。 (5) ③ :将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切。 (6)摇匀:盖好瓶塞 ,反复上下颠倒,然后静置。 |
思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、 ④ 。 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度 ⑤ (填“>”、“=”或“<”)2.00mol/L。 |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:填空题
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)硫酸铁铵[NH4Fe(SO4)2·12H2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。写出硫酸铁铵溶液中离子浓度的大小顺序 。
(2)FeSO4/KMnO4工艺与单纯混凝剂[FeCl3、Fe2(SO4)3]相比,大大降低了污水处理后水的浑浊度,显著提高了对污水中有机物的去除率。二者的引入并未增加沉降后水中总铁和总锰浓度,反而使二者的浓度降低,原因是在此条件下(pH约为7)KMnO4可将水中Fe2+、Mn2+氧化为固相的+3价铁和+4价锰的化合物,进而通过沉淀、过滤等工艺将铁、锰除去。已知:Ksp(Fe(OH)3=4.0×10-38,则沉淀过滤后溶液中c(Fe3+)约为 mol·L-1。写出生成+4价固体锰化合物的反应的离子方程式 。
(3)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如图:
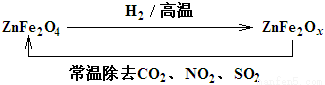
用ZnFe2Ox除去SO2的过程中,氧化剂是 。(填化学式)
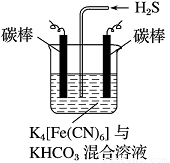
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。先通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO+H2S=2[Fe(CN)6]4-+2HCO+S↓。电解时,阳极的电极反应式为 ;电解过程中阴极区溶液的pH (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
某化学小组为探究草酸的性质并制备草酸钠及其用途,查阅到如下信息:

探究草酸部分性质并制备草酸钠的生产流程如下:
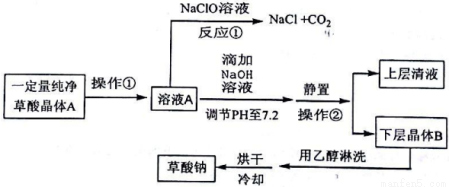
请回答下列问题:
(1)写出反应①的化学方程式__________。表明草酸具有__________性。
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些.其目的是__________。该反应达到终点时的化学方程式为__________。
(3)操作②的名称是__________。用乙醇淋洗晶体B的目的是__________
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会__________:操作中需用__________滴定管(填“酸式”或“碱式”),当达到反应终点时的现象是__________;测得此时消耗上述高锰酸钾溶液20.00mL,则该草酸钠溶液浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:实验题
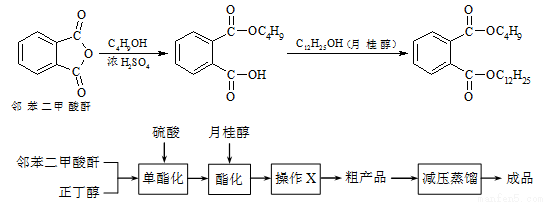
邻苯二甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约0.97g/cm3,常用作聚氯乙烯等树脂的增塑剂。工业上生产原理和工艺流程如下:
有关物质的物理性质见下表:
化合物 | 溶解性 | 熔点 | 沸点 |
邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
某实验小组的同学模拟工业生产的工艺流程,用右图所示装置制取少量邻苯二甲酸丁基月桂酯,图中夹持和加热装置已略去。主要操作步骤如下:
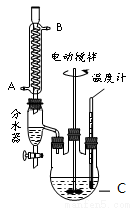
①向三颈烧瓶内加入30 g 邻苯二甲酸酐、16 g 正丁醇以及少量浓硫酸。
②搅拌,升温至105 ℃,持续搅拌反应1小时。
③冷却至室温,加入40 g 月桂醇,升温至160 ℃,搅拌、保温至反应结束。
④冷却至室温,将反应混合物倒出。
⑤通过工艺流程中的操作X,得到粗产品。
请回答下列问题:
(1)仪器C的名称___________。冷凝管中冷水应从___________进。
(2)步骤③中判断反应已结束的方法是___________。
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括___________。
(4)工艺流程中减压蒸馏的目的是___________。
(5)实验结果表明步骤②、③产率都比较高,原因是___________。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率。她成为首获科学类诺贝尔奖的中国人。青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯。下列有关说法正确的是
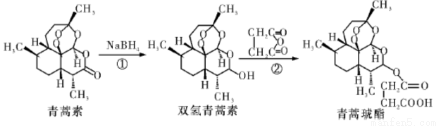
A.青蒿素分子式为C15H24O5
B.反应②原子利用率为100%
C.该过程中青蒿素生成双氢青蒿素属于氧化反应
D.1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
已知高炉炼铁的化学方程式为Fe2O3+3CO 2Fe+3CO2。下列对该反应的叙述不正确的是
2Fe+3CO2。下列对该反应的叙述不正确的是
A.CO是还原剂 B.Fe2O3被还原
C.属于氧化还原反应 D.属于置换反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中文科化学试卷(解析版) 题型:选择题
下列有关物质用途的叙述中,不正确的是
A.Cl2常用于自来水消毒 B.SO2常用于漂白食品
C.SiO2常用于制造光导纤维 D.Na2O2可用于呼吸面具中氧气的来源
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:填空题
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
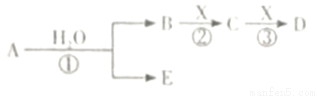
(1)若D为白色胶状难溶物,且与A摩尔质量相等,反应③的离子方程式为: 。
(2)若A为CO,则D的化学式为 。
(3)若C为当今需要减排的一种常见的温室气体,E为一种弱酸(无氧酸),则A的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是
A.同主族元素从上到下,其氢化物的稳定性逐渐增强
B.同周期元素(0族除外) 从左到右,原子半径逐渐减小
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com