
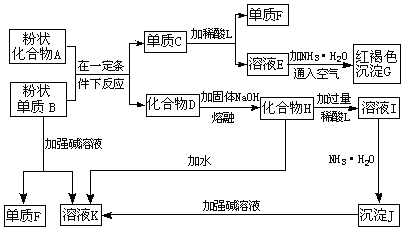
分析 G是红棕色沉淀,则G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,则单质C为Fe,铁和酸反应生成亚铁盐和氢气,所以F是H2;
粉末状单质B能和强碱溶液反应生成氢气和溶液K,AB两种固体在一定条件下反应生成铁,且B为单质,说明二者发生铝热反应,则B是Al,D为Al2O3,A为铁的氧化物,K为偏铝酸盐,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,所以H为NaAlO2,H溶于水生成偏铝酸钠溶液,所以K为NaAlO2,偏铝酸钠和过量酸反应生成铝盐,铝盐和氨水反应生成Al(OH)3,所以J是Al(OH)3,再结合题目解答.
解答 解:(1)通过以上分析知,F为H2,故答案为:H2;
(2)G是Fe(OH)3,E和氨水、空气反应生成氢氧化铁,则E中含有亚铁离子,亚铁离子和氨水反应生成氢氧化亚铁、铵根离子,氢氧化亚铁和水、氧气生成氢氧化铁,所以总的离子方程式为:4Fe2++8NH3•H2O+O2+2H2O=4Fe(OH)3↓+8NH4+,故答案为:4Fe2++8NH3•H2O+O2+2H2O=4Fe(OH)3↓+8NH4+;
(3)偏铝酸钠和过量酸反应生成钠盐、铝盐和水,所以溶液I中所含金属离子是钠离子和铝离子,故答案为:Al3+和Na+;
(4)由铁生成亚铁盐和氢气,若改为浓酸,则浓酸不是浓硫酸或浓硝酸,常温下,浓硝酸和浓硫酸能与铁发生钝化反应,生成铁盐不是亚铁盐,
故答案为:H2SO4或HNO3;
(5)B是Al,则B→F+K的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑;故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(6)反应I→J是铝离子和一水合氨反应生成氢氧化铝和铵根离子,反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(7)H为NaAlO2,H→I即偏铝酸钠和过量酸反应生成铝盐和水,离子方程式为AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O.
点评 本题考查无机物推断,正确找出题中突破口是解本题关键,再结合物质之间转化关系采用正逆结合方法进行推断,注意稀硝酸和铁反应不生成气体单质,为易错点.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:多选题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 硫酸的电离方程式:H2SO4═2H++SO42- | |
| C. | S2-的结构示意图: | |
| D. | 明矾的化学式:KAl(SO4)2•12H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| A. | 增加Fe2O3固体可以提高CO的转化率 | |
| B. | 减小容器体积既能提高反应速率又能提高平衡转化率 | |
| C. | 该反应的正反应△H<0 | |
| D. | 当容器内气体密度恒定时,不标志该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,有关桶烯的说法不正确的是( )
,有关桶烯的说法不正确的是( )| A. | 不慎将桶烯洒到地面瓷砖上,可用火烤干 | |
| B. | 桶烯在一定条件下能与3molBr2发生加成反应 | |
| C. | 桶烯与苯乙烯互为同分异构体 | |
| D. | 桶烯分子中所有的碳原子一定不在同一个平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中加入少量NaHCO3固体 | B. | 在水中滴入少量稀硫酸 | ||
| C. | 在水中加入少量氯化铝固体 | D. | 将水加热到100℃,测得pH=6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 | |
| D. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 标准状况下,22.4 L CCl4和CH2O的混合物中含有6.02×1023个碳原子 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中醋酸根离子浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com