
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
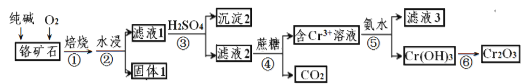
(1)Cr2O3在焙烧时生成Na2CrO4,写出第①步发生的所有方程式_________。
(2)沉淀2的化学式为_______。
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式_______,硫酸能否换成盐酸并说明其理由______。
(4)滤液3中主要溶质的化学式为____________。
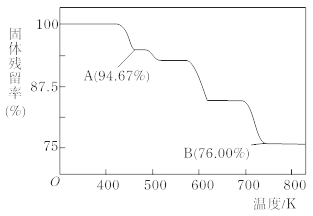
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示,则B点时铬的氧化物化学式为_______。
【答案】2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,Na2CO3+SiO2
4Na2CrO4+4CO2,Na2CO3+SiO2![]() Na2SiO3+CO2↑ H2SiO3 Cr2O72-+H2O
Na2SiO3+CO2↑ H2SiO3 Cr2O72-+H2O![]() 2CrO42-+2H+ 不能,HCl能被Cr2O72-氧化成氯气 Na2SO4、(NH4)2SO4 Cr2O3
2CrO42-+2H+ 不能,HCl能被Cr2O72-氧化成氯气 Na2SO4、(NH4)2SO4 Cr2O3
【解析】
铬铁矿(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)加入碳酸钠煅烧,可生成Na2CrO4、Na2SiO3等,加入水浸取,过滤得到滤渣为Fe2O3,滤液1为Na2CrO4、Na2SiO3等,向滤液1中加入稀硫酸调节pH得到沉淀为H2SiO3,过滤后向滤液中加入蔗糖,用蔗糖还原,得到二氧化碳和含有Na+、Cr3+的溶液,再与氨水反应,滤液3的主要溶质是两种盐为(NH4)2SO4、Na2SO4,得到Cr(OH)3沉淀,灼烧Cr(OH)3沉淀得到Cr2O3,以此解答该题。
(1)加入碳酸钠焙烧,可生成Na2CrO4、Na2SiO3等,涉及的方程式为2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,SiO2+Na2CO3
4Na2CrO4+4CO2,SiO2+Na2CO3![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(2)由以上分析可知过滤得滤液1为Na2CrO4、Na2SiO3等,向滤液1中加入稀硫酸调节pH得到沉淀2为H2SiO3;
(3)步骤③中CrO42-转化成Cr2O72- ,反应的离子方程式为:Cr2O72-+H2O![]() 2CrO42-+2H+;盐酸具有还原性,如果用盐酸,则HCl会被CrO42-氧化产生氯气污染环境,所以硫酸不能换成盐酸;
2CrO42-+2H+;盐酸具有还原性,如果用盐酸,则HCl会被CrO42-氧化产生氯气污染环境,所以硫酸不能换成盐酸;
(4)滤液3溶液中存在Na+、NH4+、SO42+等离子,主要溶质是两种盐为Na2SO4、(NH4)2SO4;
(5)设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×![]() =52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为:76g-52g=24g,两者的个数比为
=52g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为:76g-52g=24g,两者的个数比为![]() :
:![]() =2:3,所以B点时剩余固体的成分是Cr2O3。
=2:3,所以B点时剩余固体的成分是Cr2O3。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有质量比为11:14的CO2和CO的混合气体,则该混合气体中的CO2和CO物质的量之比为_________,碳原子和氧原子的个数比为________ ,该混合气体的摩尔质量为__________ 。
(2)12.4g含Na2X中含Na+0.4mol,则Na2X的摩尔质量是________ ,X的相对原子质量是____________。
(3)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L人造空气的质量是4.8g,其中氧气和氦气的分子数之比是_____________,氧气的质量是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因_________;农业上用石膏降低其碱性的反应原理____________。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
H3O++OH-向水中加NaHSO4固体,水的电离平向________移动,且所得溶液显_____性。
(3)若取 pH、体积均相等的NaOH和氨水分别加水稀释 m倍、n稀释后pH仍相等,则 m______n(填“>”“<”或“=”);
(4)常温下,在pH=6的CH3COOH与CH3COONa 的混合溶液中水电离出来的c(OH-)=_________;
(5)在如图坐标纸上画出用0.1000mol/LNaOH滴定20.00mL0.1000mol/LHCl的滴定曲线示意图。
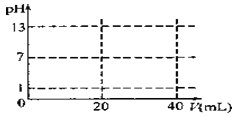 ______
______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。工业上常从锌矿冶炼的废渣中回收镓。已知某锌矿渣主要含Zn、Si、Pb、Fe、Ga的氧化物,利用该矿渣制镓的工艺流程如下: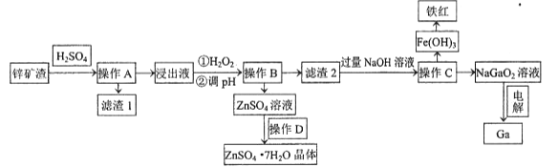
已知:①镓在元素周期表中位于第四周期第ⅢA族,化学性质与铝相似。
②lg2=0.3 lg3=0.48。
③部分物质的Ksp如下表所示。
物质 | Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)为了提高酸浸速率,除适当增加硫酸浓度外,应采取的措施有__________________(写出两条)。滤渣1的主要成分是硫酸铅及_________________(写化学式)。
(2)加入H2O2的目的是(用离子方程式表示)______________________ 。
(3)室温条件下,若浸出液中各阳离子的浓度均为0.01mo/L,当溶液中某种离子浓度小于1×10-5mol/L时即认为该离子已完全除去,则pH应调节的范围为___________________。
(4)操作D包括:_______________过滤、洗涤、干燥。
(5)电解法制备金属镓。用惰性电极电解NaGaO2溶液即可制得金属镓,写出阴极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX和2molY发生反应:X(g)+2Y(g)![]() mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
mZ(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入5molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A. 两次平衡的平衡常数相同B. m=3
C. X与Y的平衡转化率之比为1:2D. 第二次平衡时,Z的浓度为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
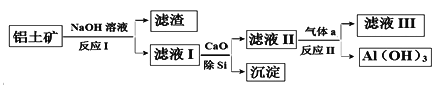
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的X和Y两种微粒,化学性质一定相似的是
A. 结构示意图:X为![]() ,Y为
,Y为 ![]()
B. X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C. X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D. X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
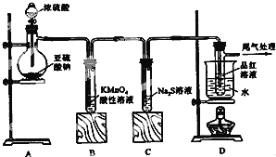
下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是___ ,发生反应的化学方程式为___;
(2)实验过程中,装置B、C中发生的现象分别是___、___,这些现象分别说明SO2具有的性质是___和___;装置C中发生反应的离子方程式为___;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___;
(4)尾气可采用___溶液吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com