

| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
| 1.4 |
| 5 |


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、金属钠在氯气中燃烧会产生棕黄色烟 |
| B、漂粉精在空气中容易失效的原因是次氯酸钙不稳定,易分解 |
| C、氯水经光照后产生的气体是挥发的氯气 |
| D、常温下1体积水中能溶解2体积Cl2,所以饱和氯水是稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14C和14N质量数相同,互为同位素 |
| B、12C和14N含有相同的中子数 |
| C、12C和13N中子数相同,质子数不同,互为同位素 |
| D、12CO和14CO物理性质不同,化学性质基本相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 已知:银氨溶液制备反应为 Ag++2NH3?H2O═[Ag(NH3)2]++2H2O. 反应结束后试管C底部有黑色沉淀生成,分离出上层清液和底部黑色固体备用. |
查看答案和解析>>
科目:高中化学 来源: 题型:
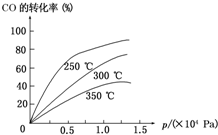 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com