
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1.8 g NH4+中含有的电子数为1.1NA
B.2.2 g CO2和N2O的混合气体中原子数为0.15NA
C.1 mol Na2O2与足量CO2反应,转移电子数为2NA
D.25 ℃、101 kPa时,2.24 L CH4含有的质子数为1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的粗表,①~⑧分别表示元素周期表中对应位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用电子式表示①与②形成化合物A 的过程:________
(2)已知⑥原子的最外层有2个电子,请画出⑥原子的结构示意图:______________
(3)含有④元素的某种18 电子的离子与H+及OH-均可发生反应,请写出该离子的电子式______
(4)元素③④⑤的简单气态氢化物的稳定性由强到弱的顺序是_________(用化学式表示),其沸点由高到低的顺序是_______ (用化学式表示)
(5)已知⑦的稳定化合态为+2 价,且⑦与③可按3:4 形成某化合物,该化合物具有较强氧化性, 可以与浓盐酸反应并释放出一种黄绿色的气体, 请写出该化学方程式:_________________
(6)①与③,①与④能形成18个电子的化合物,此两种化合物在溶液中发生反应的化学方程式为_________。
(7)⑧的一种氧化物为无色气体,在空气中能迅速变成红棕色。在一定条件下,2L的该无色气体与0.5 L 的氧气混合,该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则所生成的一种含氧酸盐的化学式是_________。
(8)两种均含①与②③④四种元素的化合物相互反应放出气体的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通人BaCl2溶液至饱和的过程中,始终未观察到溶液中出现浑浊,若再通入另种气体A,则产生白色沉淀。制备气体A的试剂不可能是( )
A.Cu和浓硝酸
B.NaOH和浓氨水
C.大理石和稀盐酸
D.MnO2和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀;
已知:向Ag+溶液中滴加氨水,先产生沉淀,继续滴加氨水,沉淀溶解。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是_____;所含阴离子相同的两种盐的化学式是________。
(2)D的化学式为____________,D溶液显碱性的原因是(用离子方程式表示)_____________。
(3)A和C的溶液反应的离子方程式是_______________;E和氨水反应的离子方程式是_______________。
(4)若要检验B中所含的阳离子,正确的实验方法是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
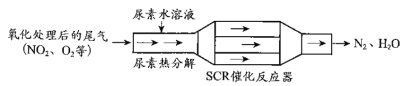
① 尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:____________。
② 反应器中NH3还原NO2的化学方程式:____________。
③ 当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:________。
④ 尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。
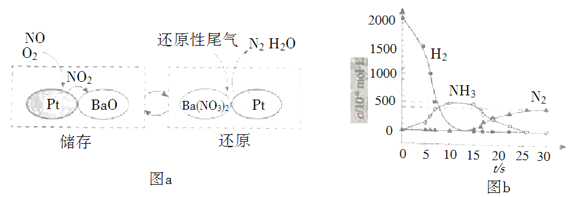
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整: _______![]() □15NNO+□H2O_______
□15NNO+□H2O_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B.红热的铁丝与水接触,表面形成黑色保护层:3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
D.“84”消毒液(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用只含有铝、铁、铜的工业合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,其实验方案如图所示:

(1)合金与NaOH溶液反应的离子方程式为_________________________________________。
(2)方案中途径②的离子方程式________________________________________________,
D中加入适量盐酸的离子方程式为________________________________________________。
(3)滤渣F的主要成分为____________________
(4)CuSO4溶液中获得胆矾的操作为蒸发浓缩,_____________、过滤_,洗涤、自然干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com