
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是( )
A.用篮子代替塑料袋 B.经常开车上班
B.经常开车上班
C.使用节能灯泡 D.节约每一滴水
D.节约每一滴水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制取少量溴苯![]() 已知该反应为放热反应
已知该反应为放热反应![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
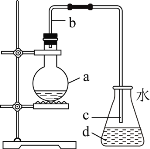
A.加入烧瓶a中试剂是苯、液溴和铁屑
B.导管b的作用是导气和冷凝回流
C.锥形瓶内可以观察到白雾,这是因为生成的HBr结合空气中的水蒸气
D.实验结束后,向d中滴入AgNO3溶液若有淡黄色沉淀生成,则可以证明苯和液溴发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品。
(1)工业中用氯气和氢气在一定条件下合成氨气,有关方程式如下: 3H2 (g)+N2(g)2NH3 (g) + 92.4 kJ
①对于该反应:要使反应物尽可能快的转化为氨气,可采用的反应条件是__________,要使反应物尽可能多的转化为氨气,可采用的反应条件是__________:(均选填字母)
A.较高温度B.较低温度C.较高压强 D.较低压强 E.使用合适的催化剂
工业上对合成氨适宜反应条件选择,是综合考虑了化学反应速率、化学平衡和设备材料等的影响。
②该反应达到平衡后,只改变其中一个因素,以下分析中不正确的是_______:(选填字母)
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小生成物浓度,对逆反应的反应速率影响更大
③某化工厂为了综合利用生产过程中副产品CaSO4,和相邻的合成氨厂联合设计了制备(NH4)2SO4的工艺流程(如图),该流程中:

向沉淀池中通入足量的氨气的目的是______________________________,可以循环使用的X是_______________。(填化学式)
(2)实验室中可以用铵盐与强碱共热得到氨气。有关的离子方程式为_____________________。
①0.01 mol/L硝酸铵溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气_____L(标准状态)。
②若有硝酸铵和硫酸铵的混合溶液0.5L,与足量的氢氧化钠溶液共热,可产生氨气0.025mol;在反应后的溶液中加入足量的氯化钡溶液,产生0.01 mol 白色沉淀,则原混合液中,硝酸铵的浓度为_______mol/L。
③现有硝酸铵、氯化铵和硫酸铵的混合溶液V L,将混合溶液分成两等分:一份溶液与足量的氢氧化钠溶液共热,共产生氨气A mol;另一份溶液中慢慢滴入C mol/L的氯化钡溶液B L,溶液中SO42-恰好全部沉淀;将沉淀过滤后,在滤液中继续滴入硝酸银溶液至过量,又产生D mol沉淀。则原混合溶液中,氯化铵的浓度为________mol/L,硝酸铵的浓度为_______mol/L。(用含有字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和代表不同元素的原子。关于此反应说法错误的是

A.一定属于化合反应
B.一定属于可逆反应
C.一定属于吸热反应
D.一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O ![]() H3O + S2- ,加水稀释,平衡向逆反应方向移动
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g) ![]() 2HI(g) :扩大容器体积,平衡不移动
2HI(g) :扩大容器体积,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用化学平衡移动原理来解释的是( )
A.加入催化剂,使N2和H2在一定条件下转化为NH3
B.将FeS2矿石粉碎更有利于焙烧制备SO2气体
C.对于反应2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
D.用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com