
| A. | 丁烯 | B. | 丁炔 | C. | 丙炔 | D. | 乙炔 |
分析 气态烃1mol最多可与2molHCl加成,说明分子中含有2个C=C或1个C≡C键,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,说明加成产物含有8个H,其中有2个H为与HCl加成生成,则原烃中含有H为6,可用排除法解答该题.
解答 解:气态烃1mol最多可与2molHCl加成,说明分子中含有2个C=C或1个C≡C键,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,说明烃分子中加成产物含有8个H,其中有2个H为与HCl加成生成,则原烃中含有H为6,只有B符合,
故选B.
点评 本题考查有机物分子式的确定,题目难度中等,本题注意根据有机物与HCl加成反应的性质判断分子中的官能团的种类和个数,结合取代反应的特点进行推断.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C15H27COOH | B. | C16H29COOH | C. | C17H31COOH | D. | C17H33COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;△\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CuO+CO═Cu+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池工作一段时间后锌皮变薄 | |
| B. | 铅蓄电池工作一段时间后两极板质量都增加 | |
| C. | 氢氧燃料电池将电能直接转变为化学能 | |
| D. | 银锌纽扣电池工作一段时间后有银单质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中溶质的质量分数为ω=$\frac{100a(M-18n)}{a+b}$% | |
| B. | 该溶液的物质的量浓度为c=$\frac{1000a}{MV}$mol•L-1 | |
| C. | 该溶液中溶剂与溶质的质量比为m(水):m(溶质)=($\frac{18na}{M}+b$):(a-$\frac{18na}{M}$) | |
| D. | 该溶液的密度为ρ=$\frac{1000(a+b)}{V}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
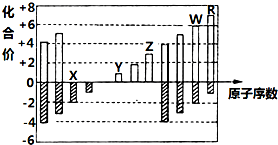 如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )
如图是部分短周期元素主要化合价与原子序数的关系图(X、Y、Z、W、R代表五种元素符号).下列说法中正确的是( )| A. | 原子半径比较:Z>Y>X | |
| B. | 最高价氧化物对应的水化物的酸性比较:W>R | |
| C. | X和Y形成的化合物中只含离子键 | |
| D. | Z的氧化物和Y的 最高价氧化物对应的水化物能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:
有aX、bY、cZ三种元素.已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的电子外围电子构型为nsnnpn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38:77.据上可推知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com