
| A. | 该元素为Mn元素 | B. | 该元素最高化合价为+7 | ||
| C. | 该元素属于d区元素 | D. | 该元素原子最外层共有7个电子 |
分析 某元素基态原子的外围电子排布为3d54s2,则原子核外电子排布式为[Ar]3d54s2的元素,其质子数为25,为Mn元素,处于周期表中第四周期ⅦB族,以此来解答.
解答 解:A.价电子构型为3d54s2的元素,原子核外电子排布式为[Ar]3d54s2的元素,其质子数为25,为Mn元素,故A正确;
B.价电子为3d54s2,该元素最高化合价为+7,故B正确;
C.核外电子最后排入的能级为3d,属于d区元素,故C正确;
D.该元素的原子最外层为4s,有2个电子,故D错误;
故选D.
点评 本题考查原子结构与元素的性质,为高频考点,把握电子排布、价电子判断元素为解答的关键,侧重分析与应用能力的考查,注意过渡元素的价电子与最外层电子,题目难度不大.


科目:高中化学 来源: 题型:解答题
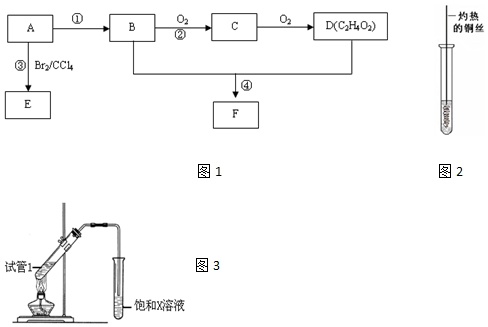
 ,D中官能团为羧基(-COOH).
,D中官能团为羧基(-COOH). CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S→SO2→SO3→H2SO4 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | N2→NO→NO2→HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的颜色不再改变 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再改变 | D. | 混合气体的平均分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、NO3-、Cl- | B. | K+、Na+、H+、Cl- | ||
| C. | K+、NH4+、S2-、CO32- | D. | Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
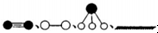 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: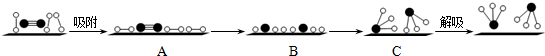
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
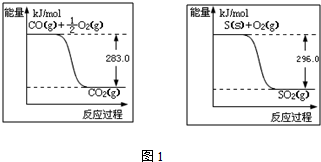
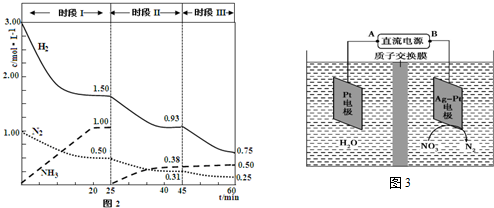
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com