
在水溶液中能大量共存的一组是( )
A.Ba2+、Na+、SO32-、Cl? B.MnO4? 、SO42? 、K+ 、H+
C.Al3+ 、Mg2+、NO3? 、HCO3? D.Fe3+、Na+、SCN? 、Cl?
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:实验题
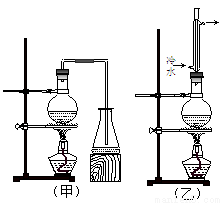
实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表:
| 乙酸 | 1-丁醇 | 乙酸丁酯 |
熔点(℃) | 16.6 | -89.5 | -73.5 |
沸点(℃) | 117.9 | 117 | 126.3 |
密度(g/cm3) | 1.05 | 0.81 | 0.88 |
水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是 (选填答案编号)。
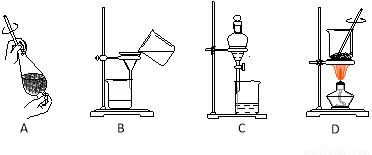
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
五种短周期元素(用字母表示)在周期表中的相对位置如下,其中Y的单质在空气中含量最高。下列判断正确的是( )

A.气态氢化物稳定性:X>Y
B.最高价氧化物的水化物的酸性:Y>M
C.R的氧化物的水化物是离子化合物
D.Z、M、R的原子半径依次减小,最高化合价依次升高
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用正确的是
A.油脂在酸性条件下水解生成高级脂肪酸和甘油
B.福尔马林可防腐,可用它保存海鲜产品
C.乙醇、糖类和蛋白质都是人体必需的营养物质
D.合成橡胶与光导纤维都属于有机高分子材料
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
25℃时,下列说法正确的是( )
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl—)>c(NH4+)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3—) >c(H2CO3)>c(CO32?)
C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性
D.将0.1 mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
已知反应①:

化合物Ⅱ可由化合物Ⅲ合成:

(1)化合物Ⅰ的分子式为 。反应①的反应类型为 。
(2)过量的化合物Ⅰ与HOOCCH2CH2COOH发生酯化反应,反应的化学方程式为 (注明条件)。
(3)化合物Ⅲ的结构简式为 。化合物Ⅲ可与NaOH乙醇溶液共热,反应的化学方程式 。
(4)化合物Ⅰ在一定条件下氧化生成化合物Ⅳ(分子式为C9H10O),化合物Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为2:2:1,Ⅴ的结构简式为 。
(5)一定条件下,1分子 与1分子
与1分子 也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.蛋白质和油脂都是天然高分子化合物
B.CO2和CH4都是造成温室效应气体
C.蔗糖和麦芽糖水解产物均为葡萄糖
D.苯酚和甲苯遇FeCl3均显紫色
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S 6Ag+Al2S3
6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原
理:
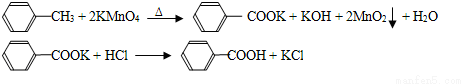
实验方法:一定量的甲苯和适量的KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
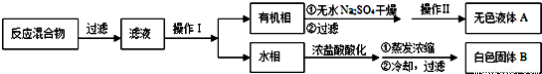
已知:苯甲酸相对分子质量122 ,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,需要用到的主要玻璃仪器为 ;操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中, 加热溶解, | 得到白色晶体和无色溶液 |
|
② | 取少量滤液于试管中,
| 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, |
| 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 g产品溶解在甲醇中配成100 ml溶液,移取2 5.00 ml溶液,滴定,消耗KOH的物质的量为2.40 × 10 -3 mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 。(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com