
| 时间(s) n(mol) | 20 | 40 | 60 | 80 | 100 | |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
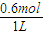 =0.6mol/L,c(N2O4)=0.4mol/L-0.3mol/L=0.1mol/L,结合K为生成物浓度幂之积与反应物浓度幂之积的比来解答;
=0.6mol/L,c(N2O4)=0.4mol/L-0.3mol/L=0.1mol/L,结合K为生成物浓度幂之积与反应物浓度幂之积的比来解答;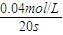 =0.002mol?L-1?s-1,故答案为:0.002mol?L-1?s-1;
=0.002mol?L-1?s-1,故答案为:0.002mol?L-1?s-1;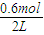 =0.3mol/L,c(N2O4)=0.2mol/L-0.15mol/L=0.05mol/L,
=0.3mol/L,c(N2O4)=0.2mol/L-0.15mol/L=0.05mol/L, =1.8mol?L-1,故答案为:1.8mol?L-1;
=1.8mol?L-1,故答案为:1.8mol?L-1; ,
, ;
;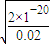 =10-9mol/L,c(H+)=10-5mol/L,所以pH=5,即生成Cu(OH)2沉淀,应调整溶液pH,使之大于5;0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=
=10-9mol/L,c(H+)=10-5mol/L,所以pH=5,即生成Cu(OH)2沉淀,应调整溶液pH,使之大于5;0.2mol/L的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,c(Cu2+)=0.0002mol/L,c(0H-)=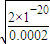 =10-8mol/L,c(H+)=10-6mol/L,所以pH=6,故答案为:5;6;
=10-8mol/L,c(H+)=10-6mol/L,所以pH=6,故答案为:5;6;

科目:高中化学 来源: 题型:阅读理解
| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |


查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高二上学期期末考试化学试卷(带解析) 题型:填空题
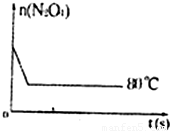
(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
(g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
110 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g) ![]() 2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com