
【题目】按要求完成下列各题:
(1)画出Li2O的电子式________________________
(2)用电子式表示CO2分子的形成过程_________________________________________
(3)画出N2分子的结构式_________________
(4)写出全部是由H、O、S、K四种元素形成的两种盐相互反应的离子方程式__________
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,写出其化学反应方程式_____________
(6)如图是元素周期表的一个方格  ,其中19.00的意义是___________
,其中19.00的意义是___________
【答案】![]()
![]() N
N![]() N H++HSO3-=SO2↑+H2O NaOH+Al(OH)3=Na[Al(OH)4] F元素的相对原子质量
N H++HSO3-=SO2↑+H2O NaOH+Al(OH)3=Na[Al(OH)4] F元素的相对原子质量
【解析】
(1)Li2O是离子化合物,含有离子键,电子式为![]() ;
;
(2)CO2分子是共价化合物,含有极性键,其形成过程为![]() ;
;
(3)氮气分子中含有氮氮三键,结构式为N![]() N;
N;
(4)全部是由H、O、S、K四种元素形成的两种盐相互反应,这说明是硫酸氢钾和亚硫酸氢钾,二者反应的离子方程式为H++HSO3-=SO2↑+H2O;
(5)第3周期的两种金属氧化物对应的水化物间能相互发生反应,说明含有两性氢氧化物,因此只能是氢氧化钠和氢氧化铝,反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4];
(6)根据方格 可判断其中19.00表示F元素的相对原子质量。
可判断其中19.00表示F元素的相对原子质量。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)写出B、C、E元素的名称B___、C___、E___。
(2)请写出含C质量分数最高的化合物的化学式:______ 。
(3)A、C、D、F四种元素可以形成两种可以互相反应的酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为______、______。
(4)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为________________________。
(5)向含有a molE离子的氯化物溶液中加入含b molD的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为_______________________________ 。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0⑥(4a-b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
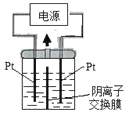
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见的有机物转化关系(部分相关物质和反应条件已略去)。
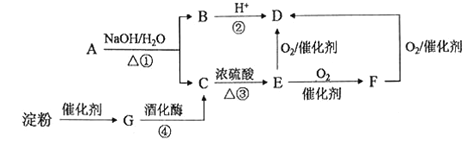
(1)写出E的官能团名称:____________;
(2)③的反应类型为 _______________;
(3)写出反应①的化学方程式:__________________________________;
(4)下列有关上述有机物的说法正确的是____________________。
A.将绿豆大小的钠块投入C中,钠块浮于液面上,并有大量气泡产生
B.可用新制Cu(OH)2鉴别C、D、F三种无色液体(实验过程可加热)
C.G能够发生酯化、水解、氧化、加成等反应
D.相同物质的量的C、E充分燃烧时消耗等量的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
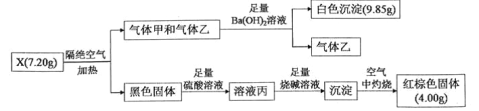
已知:气体甲和气体乙组成元素相同,物质的量之比为1:1。请回答:
(1)X的化学式为___________。
(2)溶液丙与H2O2溶液在酸性条件下反应的离子方程式是___________________________。
(3)写出利用流程图中某种物质将红棕色固体重新转化为黑色固体的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应: 2SO3 (g)![]() 2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是
2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是

A. 0~8min内v(SO3)=0.025mol/(L·min)
B. 8min时,v逆(SO2)=2v正(O2)
C. 8min时,容器内压强保持不变
D. 若8min时将容器压缩为1L,n(SO3)的变化如图中a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com