
| 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| K=6.2×10-10 | Ka1=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入CO2:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液的pH>7 | |
| D. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 |
分析 A.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,根据电离平衡常数知,HF的酸性大于H2CO3,结合强酸制取弱酸判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.水解常数Kh=$\frac{Kw}{Ka}$,根据水解常数与电离常数的大小分析;
D.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小;
解答 解:解:A.根据电离平衡常数知,HF的酸性大于H2CO3,结合强酸制取弱酸知,F-和二氧化碳不反应,故A错误;
B、相同浓度相同体积的NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN),不知道NaCN与HCN的物质的量的多少,无法判断,故B错误;
C.0.2 mol•L-1 HCN溶液与0.1mol•L-1NaOH溶液等体积混合后,溶液中的溶质为等浓度的HCN和NaCN,水解常数Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5,水解常数大于电离常数,则水解程度大于电离程度,由于水解显碱性,所以溶液的pH>7,故C正确;
D.酸的电离平衡常数越大,其电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐溶液pH越小,CN-的水解程度大于F-,所以等浓度的NaCN和NaF溶液中PH值前者大于后者,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸电离程度、酸根离子水解程度的关系是解本题关键,再结合物料守恒、电荷守恒解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
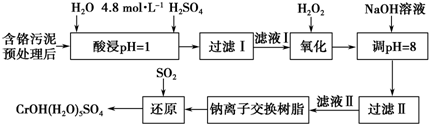
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
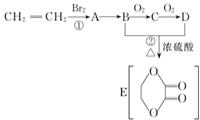 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)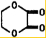 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl 和NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4 和Ca(OH)2 反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 2CO2(g)═2CO(g)+O2(g)△H=+2×283.0 kJ•mol-1则 CO(g)的燃烧热是-283.0 kJ•mol-1 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1min内的平均速率为v(SO3)=0.088/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010molO2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| C. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu、CuSO4、正极 | B. | Cu、CuCl2、负极 | C. | CuCl2、Cu、正极 | D. | Cu、CuSO4、负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com