
下列说法正确的是
A.14C、14N互为同位素
B.H2 O、CH3COOH、NH4 HCO3都属于电解质
C.铝、铁、铜对应的氧化物均为碱性氧化物
D.金属阳离子被还原时一定得到金属单质
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
【化学一一选修5:有机化学基础】(15分)
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应:F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应:M与NaOH溶液反应后的产物,其一氯代物只有一种。
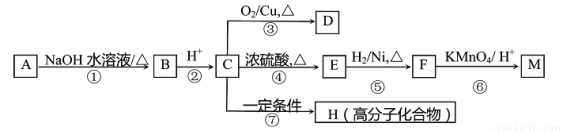
请回答:
(1)B、F的结构简式分别为: 、 。
(2)反应①~⑦中,属于消去反应的是: (填反应序号)。
(3)D发生银镜反应的化学方程式为: ;反应⑦的化学方程式为: 。
(4)A的相对分子质量在180—260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为: 。
(5)写出符合下列条件F的所有同分异构体的结构简式 。
a.能发生银镜反应
b.能与FeCl溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
短周期四种元素离子W2+、X-、Y2-、Z+的电子层结构相同。下列说法正确的是
A.原子序数:W>Z>X>Y
B.离子半径:r(W2+)>r(X一)>r(Y2-)>r(Z+)
C.Y的气态氢化物比X的气态氢化物稳定
D.氢氧化物碱性强弱:W(OH)2>ZOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列溶液中,相关微粒的浓度关系正确的是
A.MgSO4溶液:c(Mg2+)+c(H+)= c (SO4 2一)+c(OH一)
B.将0.2mol·L-1CH3 COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:c(CH3 COO一)+ c(CH3COOH)=2c(Na+)
C.将pH=2的盐酸与0.01 mo1·L-1氨水等体积混合:c(NH4+)= c (Cl一)
D.由AgCl和AgI固体混合物与水形成的悬浊液:c(Ag+)>c(Cl一) = c (I一)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z在元素周期表中的相对位置如图所示,其中X原子最外层电子数是次外层电子数的3倍。下列说法错误的是
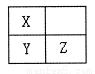
A.元素X和元素Y的最高正化合价相同
B.气态氢化物的热稳定性:H2 Y < H2 X
C.Y2 Z2是共价化合物
D.酸性:HZO4 >H2YO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:填空题
(14分)Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
A | B | C | D |
E | F |
(1)A在周期表中的位置 。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为 。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有 。检验该化合物中阳离子的方法是 。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在恒容绝热(不与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | X | Y | Z | W |
起始投料/ mol | 2 | 1 | 2 | 0 |
升高温度,该反应平衡常数将 _______(填“增大”“减小”或“不变”)。
(6)若反应在恒温、容积可变的密闭容器中进行,通过压缩容器体积改变压强,分别测得Y的平衡浓度如下表:
实验序号 | ① | ② | ③ |
压强p/Pa | 1×105 | 2×105 | 1×106 |
c(Y)/mol·L-1 | 0.08 | 0.12 | 0.68 |
当压强为1×106 Pa时,此反应的平衡常数表达式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.其他条件不变时,若增大压强,则物质Y的转化率减小
D.其他条件不变时,若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市高三上学期期末化学试卷(解析版) 题型:填空题
(8分)以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示:

(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和 (填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=a kJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式 。
(3)写出TiO2生成BaTiO3的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省咸宁市高二上学期期末考试化学(B)试卷(解析版) 题型:填空题
(14分)滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定 用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是 。
②上述滴定过程中操作滴定管的图示,正确的是 。
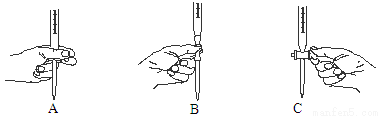
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH 溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定 用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得识,你认为合理的是 (填字母序号)。

②判断滴定终点的依据是 。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。

(3)沉淀滴定 滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
KSP | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A、NaCl B、NaBr C、NaCN D、Na2CrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com