
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:| 1 |
| 2 |


科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol | 放出的热量/kJ |
| 0 | 1.20 | 0.60 | 0 |
| t1 | 0.80 | Q | |
| t2 | 0.20 |
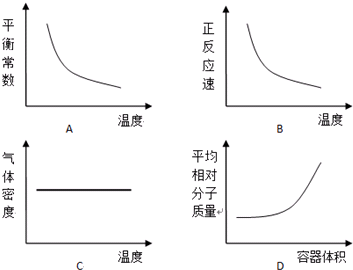
| CO | H2O | CO2 | H2 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0 | 0 |
| 平衡浓度(mol/L) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为 ).M的一条合成路线如下(部分反应试剂和条件省略).
).M的一条合成路线如下(部分反应试剂和条件省略).
| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
 与
与 的化学性质相似.
的化学性质相似.查看答案和解析>>
科目:高中化学 来源: 题型:
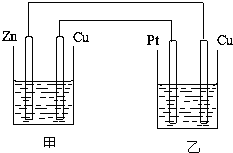 如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:
如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com