
分析 所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀为Cu(OH)2,质量为39.2g,物质的量为$\frac{39.2g}{98g/mol}$=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,故反应中硝酸有剩余,结合、电子守恒、原子守恒及c=$\frac{n}{V}$计算.
解答 解:(1)所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0mol/L×1.0L=1mol,沉淀为Cu(OH)2,质量为39.2g,物质的量为$\frac{39.2g}{98g/mol}$=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,设Cu、Cu2O的物质的量分别为x、y,则
$\left\{\begin{array}{l}{64x+144y=27.2}\\{x+2y=0.4}\end{array}\right.$,
解得x=0.2,y=0.1,
所以Cu与Cu2O 的物质的量之比为2:1,
答:Cu与Cu2O 的物质的量之比为2:1;
(2)Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2molCu完全反应失去0.4mol电子,0.1molCu2O完全反应失去0.2mol电子,总共生成0.6mol电子,由电子守恒,生成NO的物质的量为$\frac{0.6mol}{5-2}$=0.2mol,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(NO3-)=n(NaOH)=1mol/L×1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,硝酸的浓度为$\frac{1.2mol}{0.5L}$=2.4mol/L,
答:HNO3的物质的量浓度为2.4mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:推断题

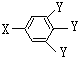
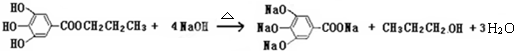
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
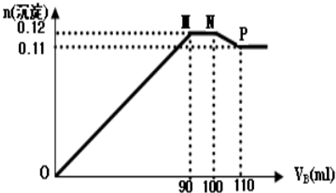
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
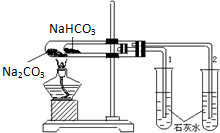 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
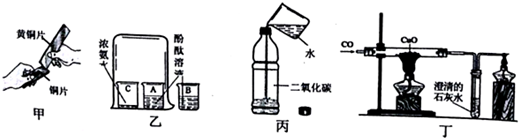
| A. | 甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com