
| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 0.5mol/L×0.25 |
| 18.4mol/L |
| n |
| V |
| n |
| V |
| n |
| V |
| n |
| V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
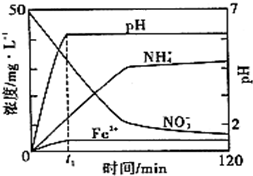 I.铁盐、亚铁盐是实验室常用的药品.
I.铁盐、亚铁盐是实验室常用的药品.| SO | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液 |
| B、NaHCO3溶液 |
| C、Na2SO3溶液 |
| D、CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C((H +)>1.0×10-7mol/L |
| B、C(CH3COOˉ)+C(OHˉ)=C(Na +)+C(H +) |
| C、C(CH3COOˉ)+C(CH3COOH)=C(Na +) |
| D、C(OHˉ)=C(CH3COOH)+C(H +) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将体积相同的pH=4的盐酸和醋酸都稀释成pH=5的溶液,醋酸所需加入的水量比盐酸的多 |
| B、盐酸和醋酸都可用相应的钠盐与浓酸酸反应制取 |
| C、相同物质的量浓度、相同体积的盐酸和醋酸溶液分别跟氢氧化钠溶液反应时,消耗氢氧化钠的量相等 |
| D、相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、某无色溶液滴入澄清石灰水中,石灰水变浑浊,则该溶液中可能含HCO3- |
| C、某无色溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则该溶液中一定有Ag+ |
| D、向某溶液中滴加氯水后,滴加KSCN溶液,溶液变红,证明溶液中含有Fe3十 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com