
分析 (1)根据反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,Fe3+在正极得到电子而被还原,电解质溶液为FeCl3,外电路中电子从负极向正极移动,根据反应的铜的质量求算电子转移的量.
(2)根据c=$\frac{n}{V}$、v=$\frac{△c}{t}$进行计算.
解答 解:(1)由反应“2FeCl3+Cu=2FeCl2+CuCl2”可知,反应中铜失电子而被氧化,应为原电池负极,正极应为活泼性比铜弱的金属或导电的非金属材料,则石墨电极为正极,Fe3+在正极得到电子而被还原,其电极反应为:2Fe3++2e-=2Fe2+,电解质溶液为FeCl3,外电路中电子从负极向正极移动;若负极减重6.4克,则溶解的Cu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,则转移的电子为0.2mol
故答案为:Cu;2Fe3++2e-=2Fe2+;0.2mol;
(2)根据三步法:
2SO2+O2=2SO3
4mol 2 0
2x x 2x
4-2x 2-x 2x
4-2x+2-x+2x=5.6,x=0.4mol;
2min末:n(SO3)=0.8mol,c=$\frac{n}{V}$=$\frac{0.8}{2}$=0.4mol/L,
v=$\frac{△c}{t}$=$\frac{\frac{2-x}{2}}{2}$=$\frac{\frac{2-0.4}{2}}{2}$=0.2mol•L-1•min1,
故答案为:0.4mol/L;0.2mol•L-1•min1.
点评 本题考查原电池的设计及原电池的工作原理,物质的量浓度和化学反应速率的相关计算,题目难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
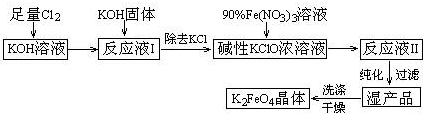
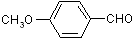 )具有多种同分异构体.
)具有多种同分异构体.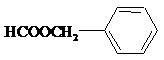 ;②
;②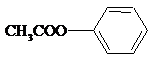 ;③
;③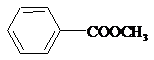 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
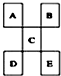
| A. | D一定是金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | B的氢化物是以分子形式存在,且某些分子间存在氢键 | |
| D. | E的原子序数一定是A的5倍,且原子半径比A大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
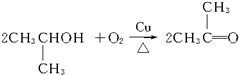 +2H2O)(只写一个)
+2H2O)(只写一个)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
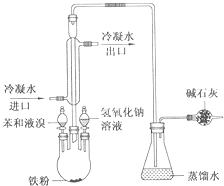 图是实验室制取溴苯的装置图
图是实验室制取溴苯的装置图 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com